Sci Immuno:中国科学技术大学崔国梁/马思聪团队合作发现鞘脂代谢产物促进肿瘤微环境中Treg细胞分化的作用机制
2024-04-28 iNature iNature
该研究测量了TME中的630种代谢物,并发现富集了丝氨酸和棕榈酸,这是合成鞘脂质所需的底物。
CD4+调节性 T(Treg)细胞在肿瘤微环境(TME)中积聚并抑制免疫系统。TME中代谢物的可用性是否以及如何影响Treg细胞分化不清楚。
2024年4月19日,中国科学技术大学&合肥综合性国家科学中心大健康研究院崔国梁教授、马思聪副研究员、中国科学院生物物理研究所高璞研究员、南京医科大学王曦教授合作在Science Immunology 发表题为“Serine enrichment in tumors promotes regulatory T cell accumulation through sphinganine-mediated regulation of c-Fos”的研究论文,该研究测量了TME中的630种代谢物,并发现富集了丝氨酸和棕榈酸,这是合成鞘脂质所需的底物。
丝氨酸和Sptlc2缺陷抑制了Treg细胞的积聚并抑制了肿瘤生长。鞘脂类合成的速率限制性酶Sptlc2介导的中间代谢物丝氨酸与转录因子c-Fos发生物理相互作用。丝氨酸-c-Fos相互作用增强了c-Fos对靠近目标基因转录起始位点的基因组范围内的招募,包括Pdcd1(编码PD-1)的基因。这促进了Pdcd1的转录,并以PD-1依赖的方式增加了体外诱导的Treg细胞分化。因此,Sptlc2介导的鞘脂类合成将代谢物可用性的细胞外信息转化为Treg细胞分化的核信号,并限制了抗肿瘤免疫。

T细胞免疫治疗方案在癌症治疗中具有重大的潜力,但目前可用的免疫疗法的疗效受到肿瘤微环境(TME)免疫抑制性的限制。CD4+ 调节性 T(Treg)细胞表达转录因子Forkhead box P3(FoxP3),在抑制抗肿瘤免疫反应中起着重要作用。Treg细胞的短暂消融会减少肿瘤生长;因此,了解Treg细胞在TME中分化和积聚的机制对于逆转TME中的免疫抑制并开发更强效的免疫疗法至关重要。
TME中的营养谱与非癌组织中的营养谱非常不同。越来越多的证据表明,营养谱的变化影响抗肿瘤T细胞反应。因此,对TME中代谢物进行系统、大规模和无偏差的定量分析对于识别免疫抑制代谢物并揭示潜在的代谢途径作为新的靶点来刺激免疫反应至关重要。
鞘脂类不仅是细胞膜中的重要结构脂质,还调节免疫细胞的迁移、分化和功能。丝氨酸和棕榈酰辅酶A,作为棕榈酸的代谢产物,通过生物合成酶丝氨酰棕榈酰转移酶(SPT)进行缩合,从而形成3-酮鞘氨醇(3-KDS),然后转化为鞘氨醇。鞘氨醇进一步促进更复杂的鞘脂类的生物合成。鞘脂类合成途径是否以及如何调节Treg细胞在TME中的积聚尚不清楚。
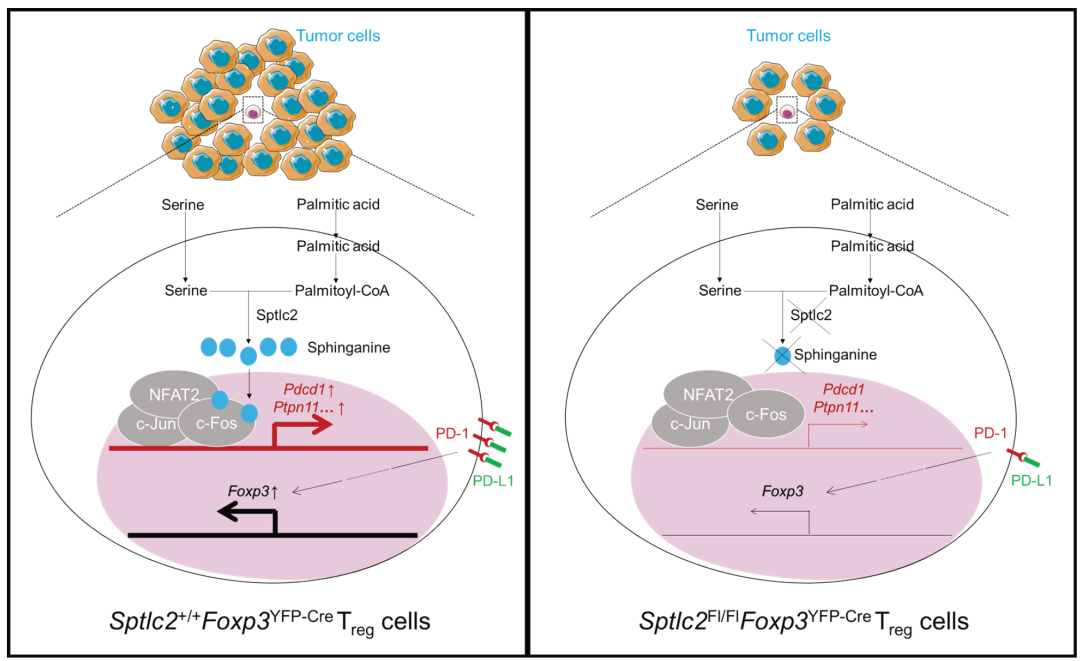
文章模式图(图源自Science Immunology )
该研究对携带肿瘤的小鼠的肿瘤间质液(TIF)和血浆中的630种代谢物进行了定量分析。作者发现TIF中鞘脂类富集,以及丝氨酸和棕榈酸的增加,这是新生鞘脂类合成的底物。通过使用具有Treg细胞特异性缺陷的小鼠模型和给小鼠喂食无丝氨酸的饮食,发现TME中的丝氨酸富集通过Sptlc2依赖的方式促进了Treg细胞的积聚。进一步的分析表明,依赖于Sptlc2的丝氨酮促进了Treg细胞的分化。
丝氨酮在依赖于三个关键氨基酸(T164、N185和L187)的方式下与c-Fos蛋白物理结合。丝氨酮促进了c-Fos对靠近目标基因Pdcd1(编码PD-1)启动子区域的招募。PD-1对丝氨酮增加FoxP3表达的作用是必需的。总的来说,这项研究揭示了丝氨酸富集通过鞘氨醇促进了TME中Treg细胞的积聚。鞘氨酮作为第二信使分子,将细胞外丝氨酸富集的信息转化为促进Treg细胞分化的细胞内信号。
中国科学技术大学&合肥综合性国家科学中心大健康研究院马思聪副研究员,德国国家癌症中心 Roger Sandhoff 博士、商傅伟博士,中国科学院生物物理研究所骆秀博士为该论文的并列第一作者。中国科学技术大学&合肥综合性国家科学中心大健康研究院崔国梁教授、马思聪副研究员、中国科学院生物物理研究所高璞研究员、南京医科大学王曦教授为该论文的并列通讯作者。
崔国梁教授长期致力于新型免疫检查点的开发和机制研究,课题组过去5年主要成果发表在 Immunity (2019, 2021), Science Immunology (2022, 2024), Nature Immunology (2023)。目前课题组经费充足,研究方向成熟稳定,已构建多种基因敲除小鼠模型即将用于靶点验证,因而课题组目前急需有免疫学工作经验的优秀博士加入。课题组工作氛围轻松,待遇优厚,课题组长及团队将为申请人提供专业的科研指导和长期的职业成长机会,详见网页https://biomed.ustc.edu.cn/2024/0316/c31898a632664/page.htm,期待加入!
参考消息:
https://www.science.org/doi/10.1126/sciimmunol.adg8817
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肿瘤微环境# #Treg# #TME#
72