浙江大学平渊教授,最新Nature Biotechnology:肿瘤免疫治疗新策略!
2024-02-11 BioMed科技 网络BioMed科技
ONCOTECH代表了一种有前景的转化技术,结合了病毒治疗和细胞治疗。
结合病毒治疗和细胞治疗的肿瘤免疫新策略!
肿瘤溶解腺病毒(OAs)在癌症治疗中的有效性受到系统注射后肿瘤递送不足以及OAs诱导免疫检查点表达倾向的限制。为了解决这些限制,浙江大学平渊利用T细胞递送OAs进入肿瘤,并改造OAs以表达针对编码免疫检查点蛋白PD-L1的PDL1基因的Cas9系统。通过将OAs与表达T细胞特异性抗原的细胞膜相结合,通过抗原-受体相互作用将OAs物理性地结合到T细胞表面。在小鼠癌症模型中,包括黑色素瘤、胰腺腺癌、肺癌和胶质母细胞瘤模型,通过静脉注射测试了肿瘤溶解病毒-T细胞嵌合体(ONCOTECH)。在黑色素瘤模型中,ONCOTECH的体内递送导致OAs在肿瘤细胞中强烈积累,PD-L1表达减少了50%,并且单次给予ONCOTECH使得70天内80%的生存率得以实现。总体而言,ONCOTECH代表了一种有前景的转化技术,结合了病毒治疗和细胞治疗。该研究以题为“An oncolytic virus–T cell chimera for cancer immunotherapy”的论文发表在《Nature Biotechnology》上。

【ONCOTECH的生成和表征】
图1展示了ONCOTECH的生成和特性。首先,通过将工程化的肿瘤特异性抗原包裹在细胞膜上,与T细胞特异性抗原结合,实现了OAs与T细胞表面的物理结合。这种结合策略不仅不影响T细胞的基本功能,而且当携带OAs的T细胞到达肿瘤细胞并识别其特异性抗原时,OAs能够迅速释放并被肿瘤细胞内化,从而促进特异性病毒感染。实验结果表明,ONCOTECH在体内递送后,能够在肿瘤细胞中强烈积累,显著降低PD-L1的表达,并在黑色素瘤模型中实现80%的生存率。这些发现表明ONCOTECH作为一种创新的肿瘤治疗策略,有效地结合了病毒治疗和细胞治疗的优势,展现出在肿瘤治疗中的潜力。
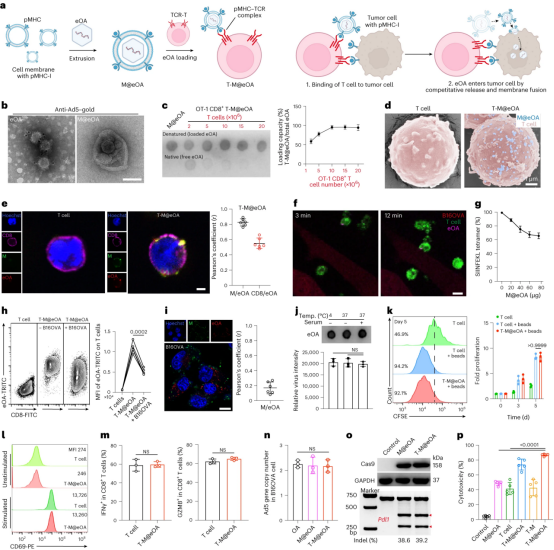
图1|ONCOTECH的生成和表征
【ONCOTECH介导的溶瘤病毒疗法和ICD级联反应】
图2描述了ONCOTECH介导的肿瘤溶解病毒治疗和免疫原性细胞死亡(ICD)级联反应。研究发现,经过T-M@eOA(肿瘤溶解病毒-T细胞嵌合体)处理的B16OVA肿瘤细胞表现出显著增加的ICD标记物水平,如钙网蛋白(CRT)、热休克蛋白70(HSP70)、ATP和高迁移率族蛋白1(HMGB1),这表明了强烈的ICD效应。同时,T-M@eOA有效地破坏了B16OVA细胞中Pdl1基因组位点,降低了PD-L1的表达。此外,T-M@eOA处理还增强了抗原呈递能力,通过与骨髓源性树突状细胞(BMDCs)共培养,显著提高了MHC-I-OVA257-264复合物的水平,这表明了强烈的抗原交叉呈递效应和树突状细胞到T细胞的免疫激活。在三维多细胞球体模型中,T-M@eOA处理增加了OVA肽SIINFEKL的呈递,增加了M1型巨噬细胞的数量,并减少了免疫抑制性调节性T细胞(Treg)的水平。这些结果表明,ONCOTECH通过提升内源性T细胞和外源性携带OVs的T细胞的效应功能,重新编程了免疫抑制性的肿瘤微环境,从而抑制了三维肿瘤球体的生长。
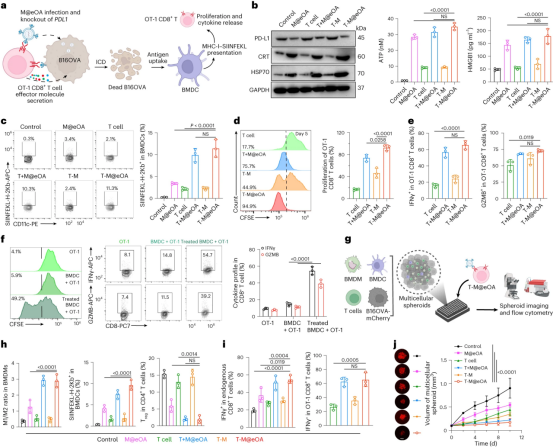
图2|ONCOTECH介导的溶瘤病毒疗法和ICD级联反应
【ONCOTECH重塑免疫抑制性TME】
图3展示了ONCOTECH治疗在体内重塑免疫抑制性肿瘤微环境(TME)的效果。研究观察到,在B16OVA肿瘤携带小鼠中,T-M@eOA(肿瘤溶解病毒-T细胞嵌合体)治疗后,肿瘤区域出现了强烈的Cy7信号(标记eOA),并且大多数携带T细胞(DiR标记)也集中在肿瘤区域。与单独的M@eOA或T+M@eOA(T细胞和eOA的物理混合物)相比,T-M@eOA在肿瘤组织中诱导了更强的基因表达。这表明,OVs和T细胞的整合递送(T-M@eOA)而非物理混合(T+M@eOA),可能协同提高了OVs的靶向能力和携带T细胞的浸润。此外,T-M@eOA治疗在肿瘤细胞中诱导了PD-L1基因的敲除频率,减少了肿瘤细胞和各种免疫细胞中的PD-L1表达,且在主要器官中未观察到非特异性编辑,显示了肿瘤特异性和安全性。T-M@eOA还诱导了肿瘤细胞中CRT和HSP70的过表达,以及ATP和HMGB1水平的增加,以及caspase-3、caspase-1和GSDMD的裂解,这表明T-M@eOA在体内强烈诱导了ICD效应。在淋巴结中,T-M@eOA处理后,成熟与未成熟树突状细胞的比例显著增加,并且SIINFEKL-H-2Kb的呈递显著提高,进一步促进了SIINFEKL-H-2Kb复合物向未激活T细胞的交叉呈递。此外,M1型肿瘤相关巨噬细胞(TAMs)和内源性细胞毒性CD8+ T细胞的水平也显著增加,而Treg细胞的水平在肿瘤中降低。这些结果表明,ONCOTECH治疗能够逆转免疫抑制性的TME,并通过多条途径刺激免疫系统。
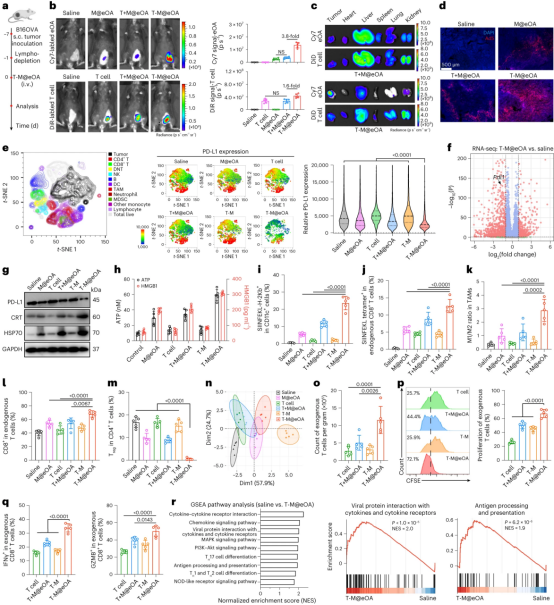
图3|ONCOTECH重塑免疫抑制性TME
【ONCOTECH在原代和播散小鼠模型中的抗肿瘤功效】
图4展示了ONCOTECH疗法在治疗实体瘤方面的有效性。在B16OVA肿瘤模型中,ONCOTECH疗法显著减缓了肿瘤生长,并且在治疗30天后,与单独使用M@eOA或T细胞相比,T-M@eOA(肿瘤溶解病毒-T细胞嵌合体)治疗组的肿瘤生长速率最慢。值得注意的是,T-M@eOA治疗在第70天时达到了80%的生存率,这表明其治疗效果优于单独的T细胞或M@eOA治疗。此外,当CD4+ T细胞被耗尽时,T-M@eOA的抗肿瘤效果降低,这表明CD4+ T细胞在ONCOTECH疗法中起着重要作用。长期免疫记忆效应的研究表明,T-M@eOA治疗后,响应者中的CD4+ T细胞数量显著增加,这表明ONCOTECH能够激发强烈的免疫记忆反应。在对完全响应的T-M@eOA治疗组小鼠进行再次挑战时,7只小鼠中的肿瘤生长完全被抑制,并且长期完全缓解维持超过90天。这些结果表明,ONCOTECH疗法不仅在短期内有效,而且能够诱导长期的抗肿瘤保护。此外,ONCOTECH疗法与抗CTLA-4抗体联合使用时,能够显著增强治疗效果,导致肿瘤生长持续抑制和生存期延长。在弥漫性肿瘤模型中,T-M@eOA治疗显著降低了肺肿瘤结节中的Pdl1基因突变和PD-L1蛋白表达,并且增加了浸润T细胞的增殖和细胞因子(IFNγ和GZMB)的分泌。这些发现共同证实了ONCOTECH疗法在治疗实体瘤方面的潜力,尤其是在激活和维持长期免疫记忆方面。
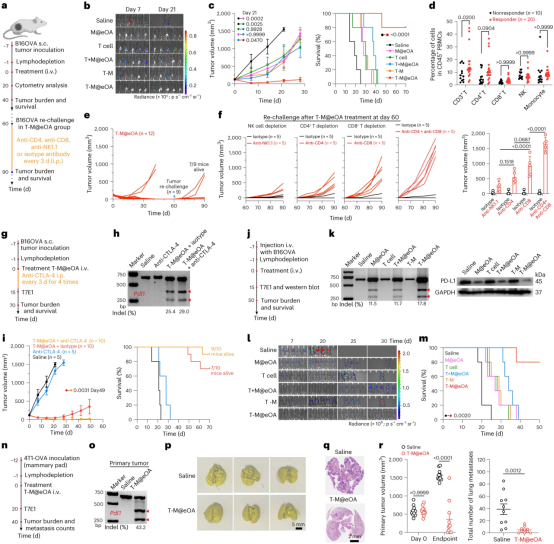
图4|ONCOTECH在原代和播散小鼠模型中的抗肿瘤功效
【病毒微囊泡-T细胞嵌合体的生物工程】
图5展示了通过CAR-T细胞介导的病毒微囊泡(MV)包装工程化eOA(工程化肿瘤溶解腺病毒)以增强对人类PDAC(胰腺导管腺癌)类器官的抗肿瘤功能。研究首先通过在293T细胞上表达前列腺干细胞抗原(PSCA),然后利用这些细胞感染eOA,通过细胞裂解素B(CB)诱导和脂质挤出技术分离出含有eOA的MV。这些MV能够通过PSCA-CAR-T细胞的特异性相互作用附着在CAR-T细胞上,且这种工程策略不影响载体CAR-T细胞识别PSCA抗原和T细胞功能,也不损害MV@eOA的感染性和基因编辑能力。在体外实验中,CAR-T-MV@eOA有效地抑制了PDAC类器官(PDO)的生长,并通过共聚焦激光扫描显微镜成像和流式细胞术分析证实了eOA在PDO细胞中的有效感染和PD-L1的下调。此外,治疗后的载体CAR-T细胞在与PDO共培养时增殖良好,并释放出多种效应分子。这些结果表明,CAR-T-MV@eOA在体外有效地抑制了PDO的生长,并且为将这种策略应用于临床相关动物模型提供了基础。
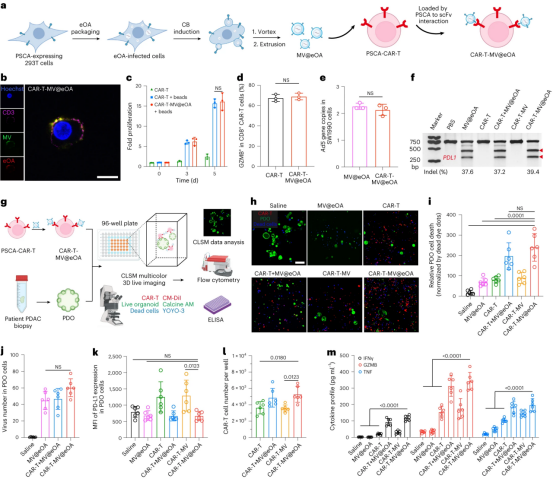
图5|CAR-T细胞组装的工程MV包装eOA,以改善对人PDAC类器官的抗肿瘤功能
【人源化PDX模型中病毒MV-T细胞嵌合体的免疫治疗】
图6展示了ONCOTECH疗法在人源化PDX(患者源性异种移植)模型中的抗肿瘤效果。研究构建了一个表达PSCA的PDAC PDX模型,并在人源化NSG小鼠中进行了PSCA-CAR-T-MV@eOA治疗。治疗后,观察到eOA(标记为Cy7)和载体CAR-T细胞(标记为DiD)在肿瘤区域的积累,与单独的MV@eOA或CAR-T+MV@eOA治疗相比,肿瘤组织中的病毒基因表达水平更高。此外,PDX肿瘤组织中的PDL1基因敲除频率显著增加,PD-L1蛋白表达降低。与对照组相比,ONCOTECH治疗后的PDX组织中免疫细胞死亡(ICD)标记物水平更高,Treg细胞数量减少,载体T细胞增殖增加,效应分子水平(如GZMB、TNF和IFNγ)增强。这些结果导致ONCOTECH疗法在20天内强烈抑制了PDX肿瘤的生长,并显著延长了肿瘤携带小鼠的生存期,其中80%的小鼠在治疗后30天内存活。在长期效应评估中,使用造血干细胞(CD34+ HSC)移植的人源化小鼠在接受CAR-T-MV@eOA治疗后,PDX肿瘤组织中的PDL1基因敲除显著,肿瘤生长在40天内得到强烈抑制,且治疗后60天内40%的小鼠存活。这些发现表明ONCOTECH疗法在临床相关动物模型中具有显著的抗肿瘤潜力,并为未来临床应用提供了有力支持。
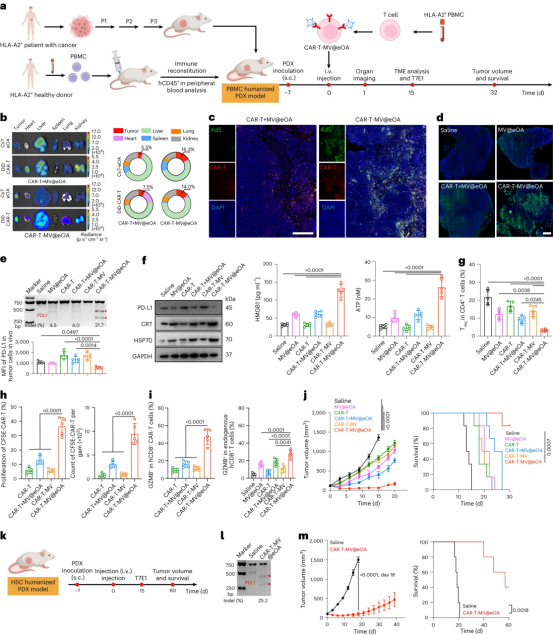
图6|针对人源化PDX模型的ONCOTECH疗法
【小结】
该研究强调了ONCOTECH作为一种有前景的转化技术,成功地结合了病毒治疗和细胞治疗。ONCOTECH通过利用T细胞递送肿瘤溶解腺病毒(OAs)进入肿瘤,并改造OAs以表达针对PDL1基因的Cas9系统,从而在肿瘤细胞中减少PD-L1的表达。在小鼠癌症模型中,包括黑色素瘤、胰腺腺癌、肺癌和胶质母细胞瘤模型,ONCOTECH显示出显著的抗肿瘤效果,特别是在黑色素瘤模型中,单次给药后70天内80%的生存率。还讨论了ONCOTECH在改善肿瘤微环境(TME)方面的潜力,通过增强内源性T细胞和外源性携带OVs的T细胞的效应功能,抑制3D肿瘤球体的生长。此外,ONCOTECH治疗在体内诱导了PD-L1基因的敲除,减少了肿瘤细胞和各种免疫细胞中的PD-L1表达,且在主要器官中没有观察到非特异性编辑,显示出肿瘤特异性和安全性ONCOTECH治疗在治疗实体瘤方面具有潜力,尤其是在与抗CTLA-4抗体联合使用时,可以显著增强治疗效果,延长肿瘤携带小鼠的生存时间。这些结果表明,ONCOTECH不仅改善了T细胞功能,而且极大地促进了整体抗肿瘤免疫反应。
原文链接:
https://www.nature.com/articles/s41587-023-02118-7
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#肿瘤免疫# #肿瘤溶解腺病毒#
21