Nature Cancer:CAR-T治疗神经内分泌肿瘤和胃肠间质瘤的安全靶点——CDH17(LI钙粘蛋白)
2022-04-05 医药魔方 医药魔方
胃肠道肿瘤(GIC,包括胃癌、胰腺癌、结直肠癌)和神经内分泌肿瘤(NET)在转移后通常是致命的。全世界每年约有500万例GIC新病例,GIC相关死亡占所有癌症相关死亡的35%。GIC的传统治疗方法包括
胃肠道肿瘤(GIC,包括胃癌、胰腺癌、结直肠癌)和神经内分泌肿瘤(NET)在转移后通常是致命的。全世界每年约有500万例GIC新病例,GIC相关死亡占所有癌症相关死亡的35%。GIC的传统治疗方法包括手术、化疗和分子靶向疗法,但转移性胃肠道癌患者的总体生存率仍然很低。近年来癌症免疫疗法取得显著进展,不过使用嵌合抗原受体(CAR)T细胞的过继性细胞疗法虽然对白血病/淋巴瘤非常有效,但对于GIC和NET等实体瘤来说处于尚待开发的阶段,部分原因是缺乏可供选择的合适的GIC或NET特异性细胞表面抗原和相应的单克隆抗体。
迄今为止,美国FDA批准的CAR-T疗法都以肿瘤相关抗原(TAA)为靶点,如CD19,其也在某些正常细胞中表达,导致正常产生抗体的B细胞被消除,需要通过注射人类IgG进行补救。此外,有研究显示,靶向HER2的CAR-T会对患者的健康肺组织造成致命毒性。因此,基于TAA开发CAR-T疗法引发了一些担忧。

3月21日,美国宾夕法尼亚大学Perelman医学院的研究人员在 Nature Cancer上发表了他们的最新研究,Carl June也参与其中。研究显示一种针对CDH17(在NET和GIC上表达但也在健康组织中发现的细胞表面标记物)的 CAR-T 细胞,在多个临床前小鼠模型实验中消除了GIC,而对小鼠正常器官(包括小肠和结肠)没有毒性。这些结果以及首次在神经内分泌瘤中靶向CDH17提出了一类有希望的,CAR-T可在肿瘤中靶向,但无法在健康组织中靶向的肿瘤相关抗原(TAA)。
首先,为了克服缺乏有价值的TAA和同源单克隆抗体的局限性,研究人员开发了一种无偏见的噬菌体展示筛选方法,以识别优先结合GI-NET细胞表面的骆驼科动物源性单域抗体(纳米抗体,VHH),并分离了特异性结合到NET的VHH1。
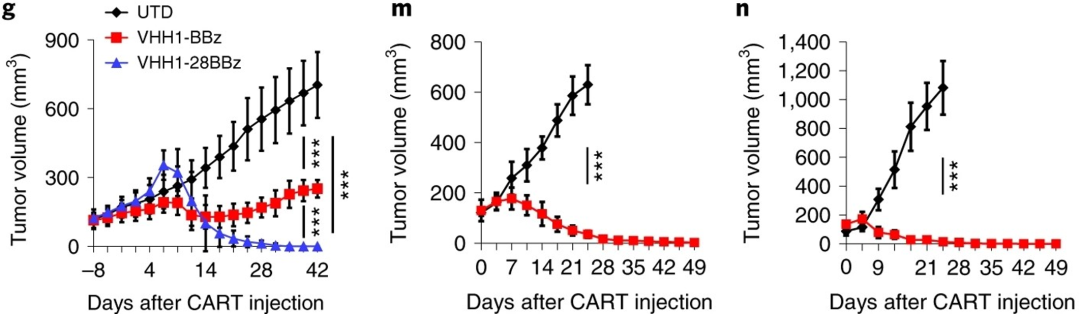
基于第一步的发现,研究人员开发了靶向CDH17的纳米抗体VHH1驱动CAR-T(CDH17CART)。体外研究显示,CDH17CART以CDH17依赖性方式杀死人和小鼠肿瘤细胞。在肿瘤异种移植或原发小鼠模型中,CDH17CART根除了表达CDH17的NET(下图g)和胃癌、胰腺癌和结直肠癌(下图m, n)。
来源:Nature Cancer
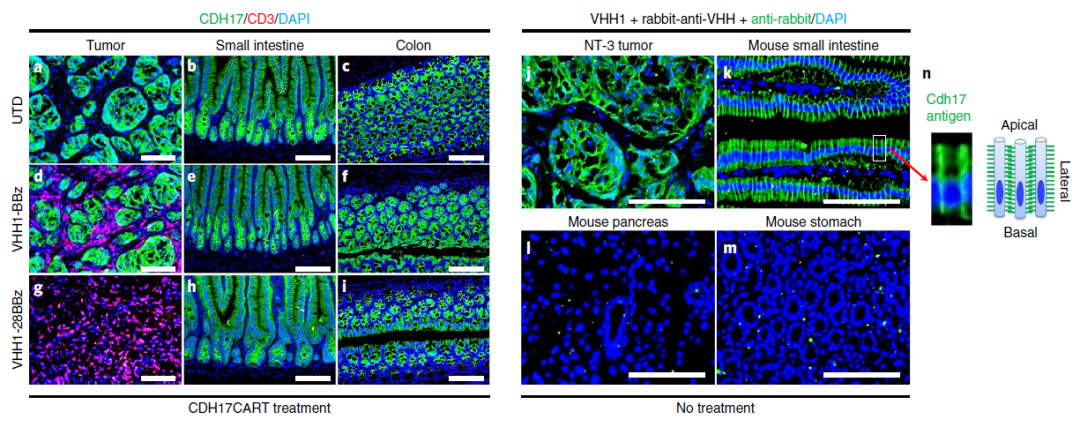
值得注意的是,CDH17CART不会攻击也表达CDH17的正常肠上皮细胞以引起毒性。安全性分析显示, 接受治疗的小鼠的健康组织:小肠和结肠完好无损,此外,在胰腺、胃、心脏、肝脏和肾脏中也未观察到明显的结构损伤。
进一步的研究显示,CDH17仅位于并局限于肠上皮细胞之间紧密连接的侧膜上,而不表达在顶端或底面(下图k, n)。相反,由于缺乏极性,肿瘤细胞在其细胞所有表面表达CDH17(下图j)。这表明,CDH17CART没有靶向正常小肠或结肠的一个原因可能是其无法到达或结合到肠上皮细胞之间紧密连接处的Cdh17。
文章第一作者 Zijie Feng 说:“ CDH17已被确定为一类有希望的新靶点,我们可以采取多管齐下的方法来靶向CDH17,并启动治疗耐药性NET和GIC的I期研究。CDH17CAR-T细胞可能特别适用于实体瘤患者,这些发现激发了对CAR-T的进一步研究,以开发靶向一些类似的先前未被重视的TAA。”
目前,关于CDH17靶点研究进展最快的是勃林格殷格翰TRAILR2/CDH17双特异性抗体BI 905711,处于I/II期临床阶段。据悉,早在2017年12月,勃林格殷格翰就已经递交该双抗靶点的发明专利。此外,香港生物制药公司Arbele用于治疗胰腺癌、胆管癌等实体瘤的CDH17单抗ARB102和CDH17/CD3双特异性抗体ARB202正处于临床前研究阶段。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#内分泌肿瘤#
83
#神经内分泌#
88
#分泌#
81
#Nat#
113
#CAR-#
81