宁波市医疗中心李惠利医院黄凤娟和廉姜芳等人JCIM论文:动脉粥样硬化相关淀粉样蛋白Medin异常聚集的分子机制
2023-11-16 ComputArt计算有乐趣 ComputArt计算有乐趣
作者通过氨基酸相互作用网络接触图分析,发现medin的30-41和42-50号氨基酸片段形成的β-hairpin是稳定medin单体构象的核心,该结构的形成驱动了medin单体的动力学折叠。
medin是由MFG-E8蛋白剪切形成的50个氨基酸的肽段,其淀粉样蛋白聚集体存在于几乎所有超过50岁的人类血管系统中,是目前已知的最普遍的淀粉样蛋白。medin纤维化聚集会引起动脉壁变性,从而导致动脉粥样硬化。研究表明,medin在血管中形成的淀粉样斑块沉积会导致脑血管功能障碍[1]。脑血管中的medin会与淀粉样蛋白Aβ直接相互作用,形成medin-Aβ聚集体,介导β淀粉样血管病变,导致脑血管功能障碍,并降低阿兹海默症患者的认知能力[2]。因此,medin可能是预防脑血管中淀粉样β沉积导致的血管损伤和认知功能下降的治疗靶点。虽然medin具有重要意义,但是其单体、寡聚体和纤维的结构仍不清楚,medin纤维化聚集的机制也尚未完全理解。为解决这一问题,本研究采用了增强采样的快速离散分子动力学模拟方法,系统地研究了medin的折叠动力学和构象特征,以及其二聚化动力学分子机制。这项研究对于理解与年龄相关的脑血管功能障碍和血管性痴呆的发病机制至关重要,同时也有助于开发预防或治疗这些疾病的新型治疗策略。相关研究成果近期发表于美国化学会出版的药物化学核心期刊Journal of Medicinal Chemistry上(J. Med. Chem. 2023, 63, 6376−6385)[3]。论文第一作者为宁波市医疗中心李惠利医院黄凤娟博士,通讯作者为宁波市医疗中心李惠利医院心内科主任廉姜芳教授、宁波大学孙运祥副教授以及美国克莱姆森大学的丁峰教授。
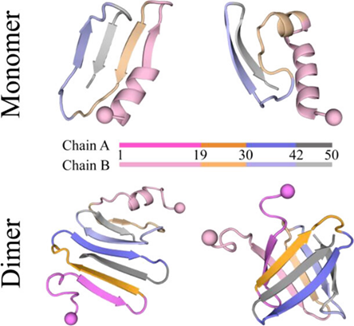
该研究通过对medin单体进行多达30组600 ns的独立离散分子动力学模拟(见图1),揭示了medin折叠的核心关键区域在其C-末端。在疏水氨基酸相互作用的推动下,medin的30-41和42-50号氨基酸片段首先形成β-sheet结构。随后,该结构诱导1-29号氨基酸吸附至β-sheet的生长面,协助其向β-sheet结构转变(见图1)。medin单体主要由3~4条β-strand组成,其中30-41和42-50号氨基酸区域的β-sheet结构相对较稳定(见图2)。相比之下,1-18和19-29号氨基酸片段虽然也呈现β-sheet结构,但其构象动态多变,稳定性较差。除了β-sheet结构,1-18号氨基酸还表现出明显的helix结构(见图2)。作者通过氨基酸相互作用网络接触图分析,发现medin的30-41和42-50号氨基酸片段形成的β-hairpin是稳定medin单体构象的核心,该结构的形成驱动了medin单体的动力学折叠。
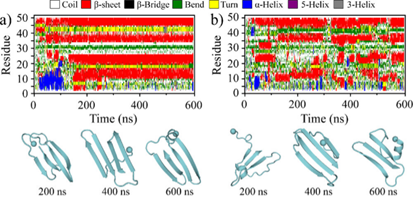
图1. Medin单体折叠动力学过程和构象特征。
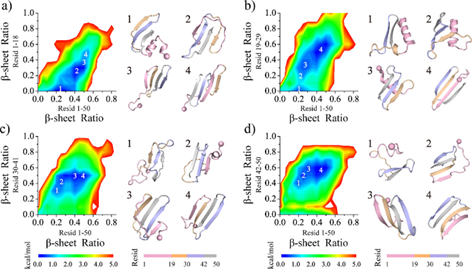
图2. 在Medin单体中1-18,19-29,30-41,42-50各氨基酸片段的构象自由能分布图。
为了深入研究medin纤维化聚集的分子机制,该研究通过60组600 ns的独立离散分子动力学模拟,探讨了两条medin单体聚集机制。通过medin二聚化动力学构象分析,发现两条游离的medin会自发聚集成稳定的含有丰富β-sheet结构的二聚体(见图3)。相较于游离的medin单体,medin二聚体的β-sheet含量也更高。这是由于medin的聚集增强了1-18和19-29号氨基酸片段β-sheet结构的稳定性,抑制了该区域由β-sheet向无序结构和helix结构的转变。由于淀粉样蛋白病理性聚集可引起细胞膜通透性的改变,导致组织器官细胞异常凋亡,β-barrel中间态被认为是淀粉样蛋白病理性聚集的潜在毒性寡聚物。有趣的是,在medin的二聚化过程中,大约有1/3的模拟轨迹中会出现不同含量的β-barrel中间态寡聚物构象。尽管由于模拟时长和采样充分性的限制,β-barrel中间态只在部分模拟中出现,但这项研究表明medin在聚集过程中也能够形成潜在毒性的β-barrel中间态寡聚物(见图3)。
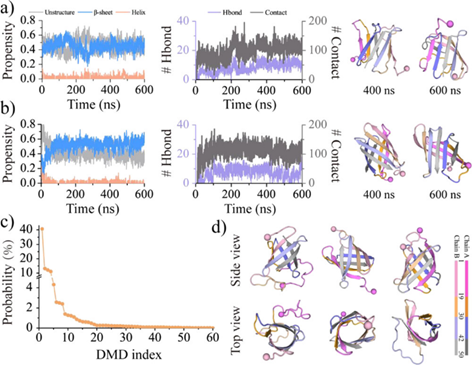
图3. 在Medin二聚化动力学构象和潜在毒性寡聚物中间态β-barrel分析。
Medin二聚体链内和链间氨基酸相互作用分析揭示,30-41和42-50号氨基酸片段形成的β-sheet结构不仅是维持medin单体构象稳定的核心,同时在medin纤维化聚集的机制中发挥了至关重要的核心作用。在Medin二聚体内,链间β-sheet主要由30-41和42-50号这两个区域参与形成,1-29号氨基酸片段链间相互作用较弱,但是1-19和20-29号氨基酸片段通过链间相互作用分别与30-41和42-50号氨基酸片段发生相互作用,形成了稳定的链间β-sheet结构(见图4)。通过对Medin二聚体中参与形成β-sheet结构的拓扑序列进行深入分析,发现维持medin聚集体稳定的主要相互作用源自疏水残基之间的紧密相互作用。30-41和42-50号氨基酸区域为推动medin纤维化核心聚集的不可或缺的关键组成部分。因此,未来研究针对抗medin纤维化聚集的药物分子抑制剂应该主要以这一区域作为核心靶点,以更深入地了解和干预与medin相关的疾病的发病机制。
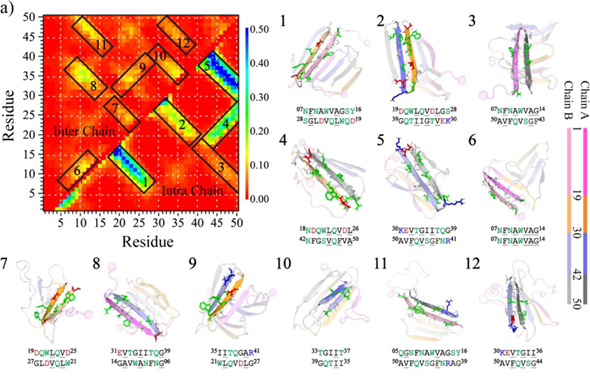
图4. Medin二聚体链内和链间的氨基酸接触频率分析。
小结:通过增强采样的全原子快速离散分子动力学模拟,在本研究中作者深入探究了medin单体的构象特征和二聚化动力学构象。研究发现,medin淀粉样蛋白30-50号残基形成的β-hairpin结构是促使其折叠成由3~4个β-strand构成的β-sheet构象的主要推动力。同时,疏水残基与30-50号残基之间的相互作用是形成链间β-sheet结构的关键,表明该区域也是促使medin纤维化聚集的核心区域。因此,该区域有望成为设计针对medin淀粉样聚集的抗淀粉样蛋白药物的靶点,这一研究也为medin单体构象和二聚化动力学提供了全面的了解,有助于更好地理解medin聚集的病理机制。
参考文献:
[1]. Degenhardt, Karoline, et al. "Medin aggregation causes cerebrovascular dysfunction in aging wild-type mice." Proc. Natl. Acad. Sci. U.S.A. 117.38 (2020): 23925-23931.
[2]. Wagner, Jessica, et al. "Medin co-aggregates with vascular amyloid-β in Alzheimer’s disease." Nature 612.7938 (2022): 123-131.
[3]. Huang, Fengjuan, et al. "Unveiling Medin Folding and Dimerization Dynamics and Conformations via Atomistic Discrete Molecular Dynamics Simulations." Journal of Chemical Information and Modeling. J. Chem. Inf. Model. 63.20 (2023): 6376–6385
作者:ComputArt计算有乐趣
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











3设计合理,学到啦
40