Eur Heart J:确定缺铁性心力衰竭的三种机制途径
2024-05-13 刘少飞 MedSci原创
铁缺乏性心力衰竭发展的三种不同机制途径为全身铁耗竭和造血障碍、骨骼和心肌细胞内铁的不成比例耗竭,这些机制可能同时起作用或依次发生在同一患者身上。

铁缺乏性心力衰竭的理解目前主要基于被认为反映全身铁储量的血液检测,但最新的证据显示这一情况更为复杂。在严重缺铁情况下,循环铁的进入和流出受到红细胞的调节,红细胞可能会牺牲造血过程向其他器官供应铁,尤其是心脏。明显的低铁血症(通常伴有贫血)可导致心肌细胞铁的耗竭,从而影响其收缩功能,这解释了为什么静脉注射铁能够降低长期试验中主要心力衰竭事件风险的能力(一型铁缺乏性心力衰竭)。然而,心力衰竭可能伴随着骨骼肌和心肌细胞内铁的耗竭,与全身铁生物标志物的发现不成比例。由炎症和脱适应介导的骨骼肌功能障碍可能导致骨骼肌细胞内铁的耗竭,即使是轻度低铁血症也可能加剧这种情况,解释了为什么静脉注射铁后患者的症状和功能能力会改善,而不管基线血红蛋白水平或血红蛋白变化如何(二型铁缺乏性心力衰竭)。此外,晚期心力衰竭患者显示心肌铁的耗竭,这既由于铁从心肌中进入减少,又由于从心肌中排出的铁增加。然而,铁补充可以在没有全身铁缺乏的情况下防止实验性损伤产生的室壁重塑和心肌病(三型铁缺乏性心力衰竭)。这些观察结果支持铁缺乏性心力衰竭发展的三种不同机制途径的可能性:一种通过全身铁耗竭和造血障碍驱动,另外两种特点是骨骼和心肌细胞内铁的不成比例耗竭。这些机制并不是相互排斥的,所有途径可能同时起作用,或者在同一患者中依次发生。
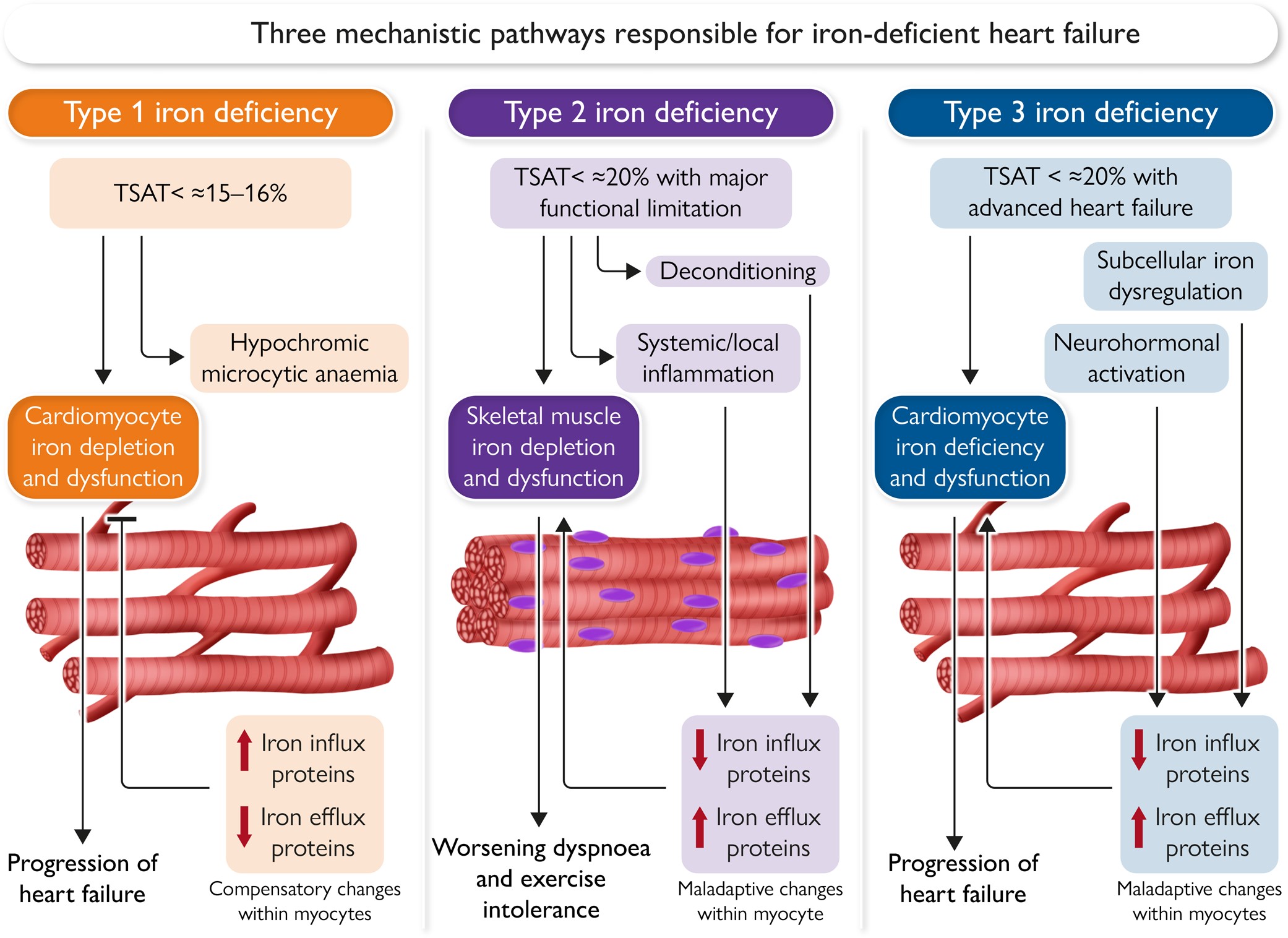
铁缺乏性心力衰竭的三种潜在机制途径。在一型铁缺乏性中,有意义的全身铁缺乏(通常TSAT <≈15%–16%,伴有贫血)导致心肌细胞铁缺乏和功能障碍,尽管心肌细胞显示出补偿性增加的铁内流蛋白和减少的铁外流蛋白。在二型铁缺乏性中,全身或局部炎症和/或脱适应导致骨骼肌细胞内细胞质铁耗竭,这是由于铁内流蛋白的减少和铁外流蛋白的增加所致;在轻度低铁血症(TSAT <≈20%)的叠加下,可能会触发严重的骨骼肌功能障碍,导致呼吸困难和运动耐受性恶化。在三型铁缺乏性中,神经内分泌激活和尚未定义的细胞亚铁稳态调节机制导致细胞质铁耗竭,这是由于铁内流蛋白的减少和铁外流蛋白的增加所致;在这些条件下,轻度低铁血症的叠加(TSAT <≈20%)可能加重心肌细胞功能障碍和心力衰竭的进展。
原始出处:
Packer M, Anker SD, Butler J, Cleland JGF, Kalra PR, Mentz RJ, Ponikowski P. Identification of three mechanistic pathways for iron-deficient heart failure. Eur Heart J. 2024 May 11:ehae284. doi: 10.1093/eurheartj/ehae284. Epub ahead of print. PMID: 38733250.
作者:刘少飞
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#心力衰竭# #缺铁#
10