读书报告 | 脑胶质瘤细胞自噬、巨噬细胞重编程和血管重塑诱导抗肿瘤免疫应答
2023-10-27 iCombo iCombo
本研究介绍了TCA(丙咪嗪)和VEGF抑制剂在胶质母细胞瘤中的协同作用,两者联用可抑制胶质母细胞瘤进展。
导读
胶质母细胞瘤(GBM)是一种侵袭性脑癌,对治疗反应不佳,进展较快。GBM的标准治疗包括手术、放疗联合化疗(替莫唑胺[TMZ]),但是平均15个月后就会复发。GBM是高度血管化的肿瘤,研究已证实,血管的生成是胶质瘤增殖和侵袭的重要因素。血管内皮生长因子(VEGF)阻断抗体贝伐珠单抗,是目前临床上批准的用于治疗GBM的药物之一,主要是基于其在减少水肿方面的作用,单药缺乏明显的生存获益。其他治疗GBM的药物仍然在试验中,因此,亟需开发新的治疗方法。
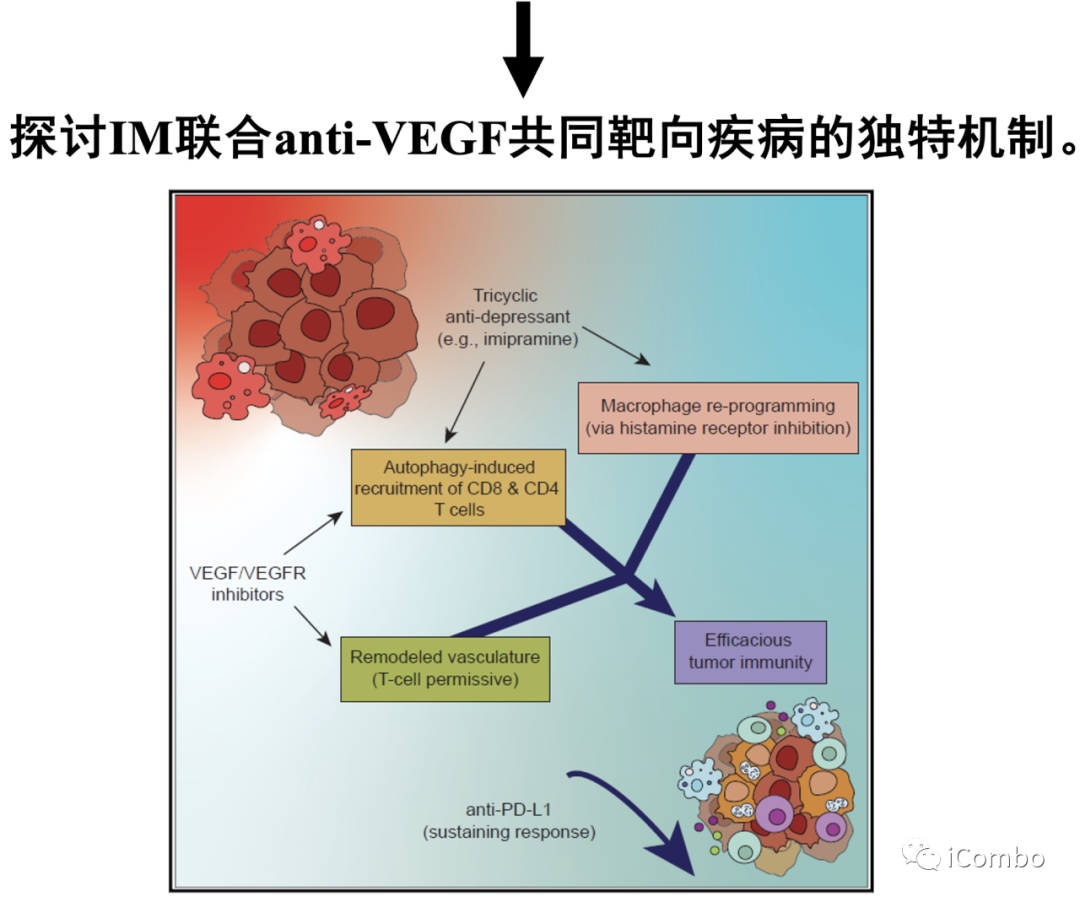
丙咪嗪(IM)属于三环类抗抑郁药(TCA),用于治疗慢性和神经性疼痛、厌食、偏头痛、焦虑障碍和昼夜节律。TCA作用机制是抑制突触前终末期的5-羟色胺和去甲肾上腺素再摄取。TCA的抗抑郁作用已得到充分证明,然而,它们的抗肿瘤特性不太清楚。已有研究发现,长期使用TCA的患者GBM的发病率更低。而且,TCA可以促进胶质母细胞瘤的自噬,在胶质母细胞瘤中,自噬可以抑制肿瘤进程,并且使得传统治疗方法的效果更好。Douglas Hanahan研究团队2015年发表在Cancer Cell的文章中发现,三环类抗抑郁药IM与抗凝血剂(P2Y12抑制剂:噻氯匹定[TIC])联用可进一步激活胶质瘤中已经升高的自噬水平,抑制胶质母细胞瘤进程。它们的组合益处归因于协同激活自噬。作者设想,共同靶向独特的肿瘤促进机制以及自噬可以产生额外的治疗益处。作者专注于肿瘤脉管系统,推断IM联合VEGF通路抑制剂可能会有协同作用。本研究旨在探讨IM联合anti-VEGF共同靶向疾病的独特机制。
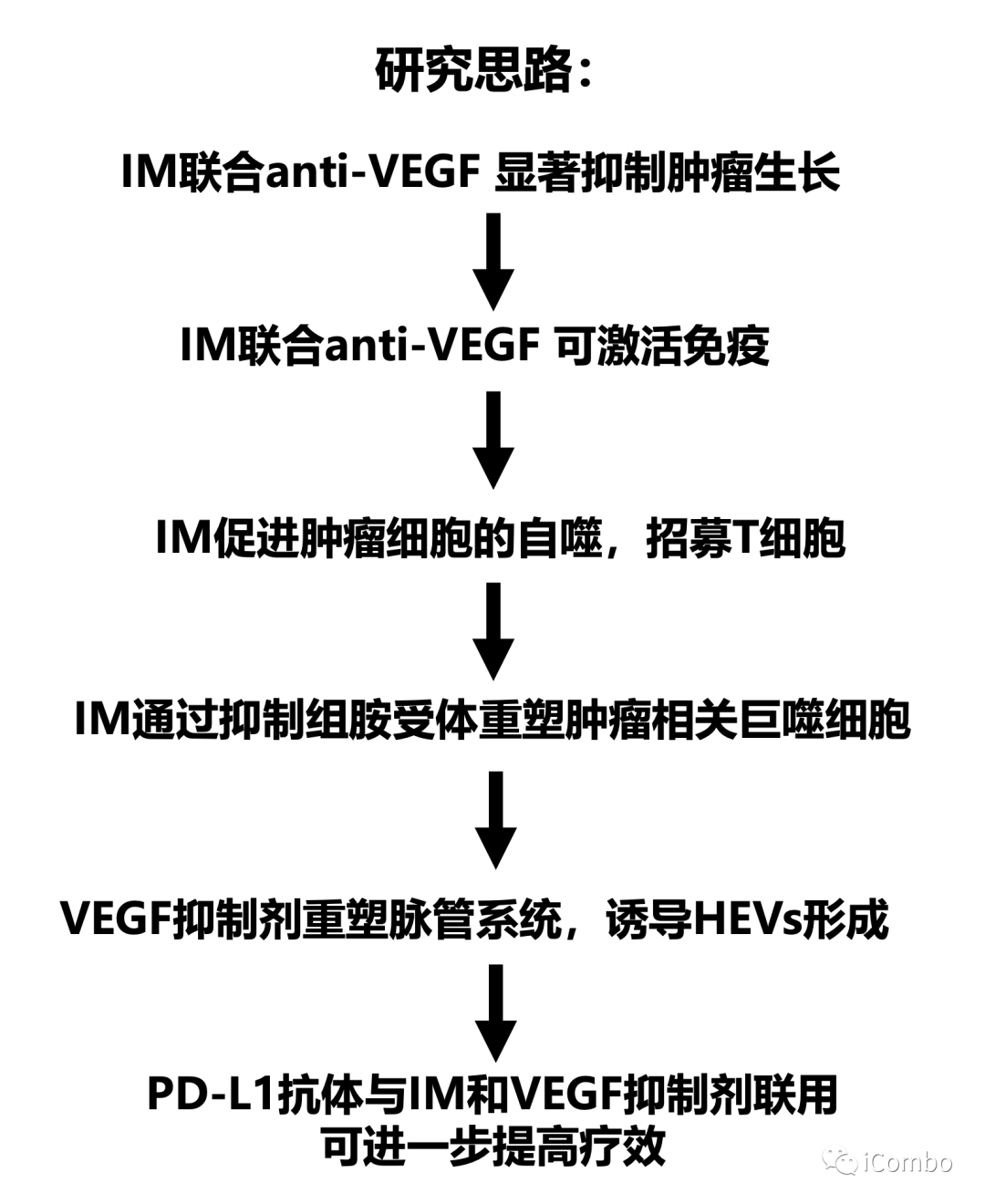
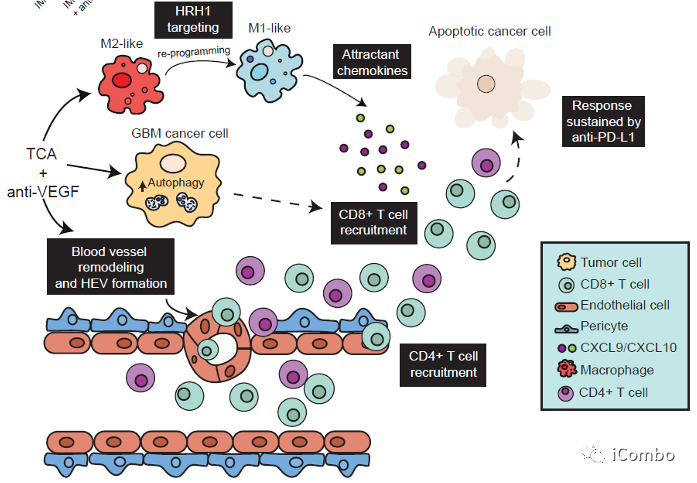
本研究介绍了TCA(丙咪嗪)和VEGF抑制剂在胶质母细胞瘤中的协同作用,两者联用可抑制胶质母细胞瘤进展。IM增加癌细胞中的自噬通量,从而募集T细胞,并通过抑制组胺受体重新编程免疫抑制性肿瘤相关巨噬细胞。VEGF通路抑制剂可重塑肿瘤脉管系统,促进T细胞侵袭和激活,诱导HEVs形成,招募淋巴细胞。IM联合VEGF通路抑制剂的组合对于CD8+和CD4+T细胞的积累和活化至关重要,使胶质瘤对抗PD-L1敏感,从而维持免疫力。因此,IM+anti-VEGF/VEGFR的组合可激活免疫,这是迄今为止免疫干预难治性致死肿瘤类型的新治疗方式(Cancer Cell. 2022 Oct 10;40(10):1111-1127.e9. doi: 10.1016/j.ccell.2022.08.014)。
Background
胶质母细胞瘤(GBM)是一种侵袭性脑癌,对治疗反应不佳,进展较快。
GBM的标准治疗包括手术、放疗联合化疗(替莫唑胺[TMZ]),但是平均15个月后就会复发。
血管内皮生长因子(VEGF)阻断抗体贝伐珠单抗,是目前临床上批准的用于治疗GBM的药物之一,主要是基于其在减少水肿方面的作用,单药缺乏明显的生存获益。
其他治疗GBM的药物仍然在试验中,因此,亟需开发新的治疗方法。
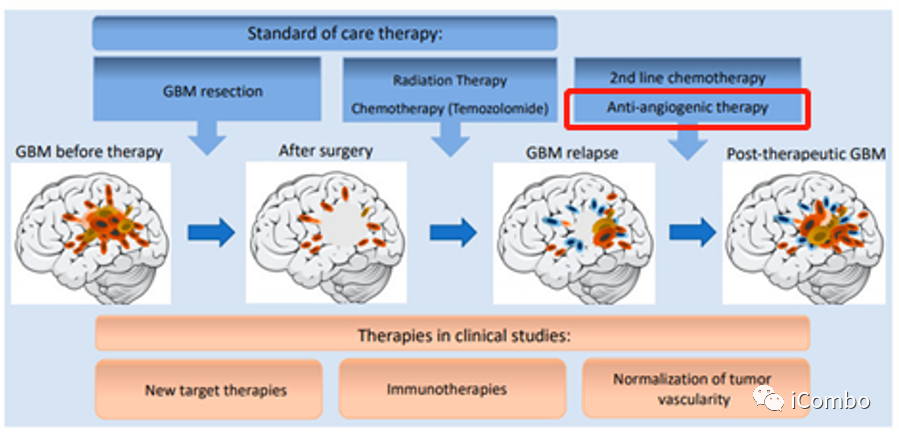
GBM是高度血管化的肿瘤,研究已证实,血管的生成是胶质瘤增殖和侵袭的重要因素。
血管内皮生长因子信号(VEGF/VEGFR)能促进新生血管形成,促进肿瘤生长。
2009年,贝伐珠单抗被美国食品药品监督管理局批准为GBM单药治疗,尽管没有证实对总生存期的益处。
丙咪嗪(IM),属于三环类抗抑郁药(TCA),用于治疗慢性和神经性疼痛、厌食、偏头痛、焦虑障碍和昼夜节律。作用机制是抑制突触前终末期的5-羟色胺和去甲肾上腺素再摄取。
TCA的抗抑郁作用已得到充分证明;然而,它们的抗肿瘤特性不太清楚。
-
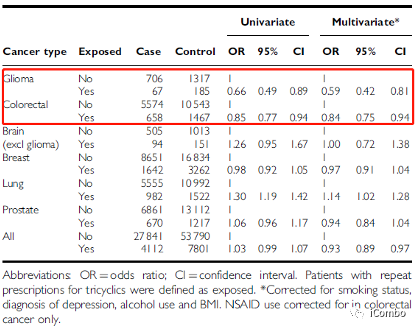
已有研究发现,长期使用TCA的患者胶质母细胞瘤的发病率更低
三环类抗抑郁药和某些癌症的发病率:使用GPRD的研究
-
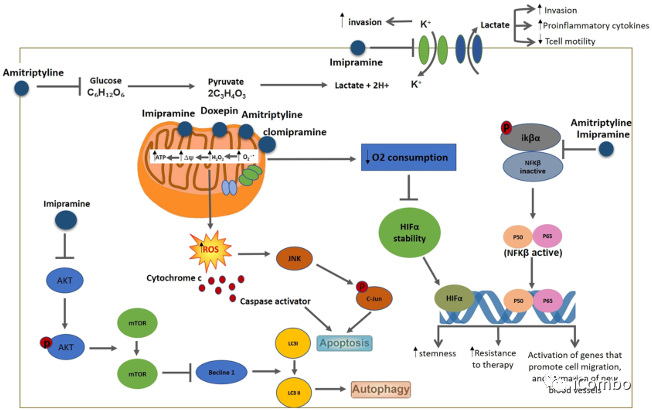
TCA在肿瘤抑制中的作用已经在一些中枢神经系统肿瘤中得到了证明,例如大鼠胶质瘤、人神经母细胞瘤和人胶质母细胞瘤。主要通过靶向线粒体,引起活性氧(ROS)的增加并减少氧的消耗。
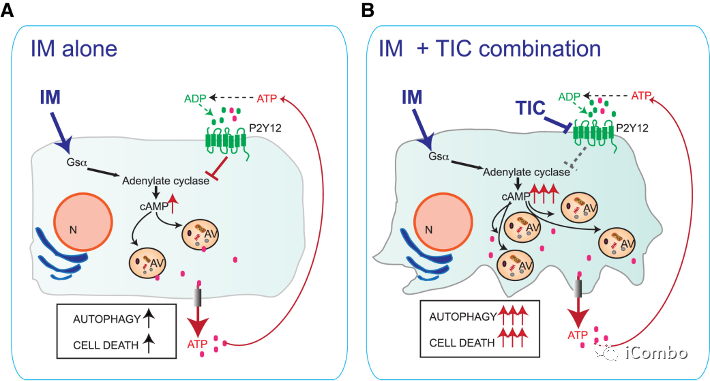
Douglas Hanahan研究团队2015年发表在Cancer Cell的文章中发现,三环类抗抑郁药IM与抗凝血剂(P2Y12抑制剂:噻氯匹定 TIC [ticlopidine])联用可进一步激活胶质瘤中已经升高的自噬水平,抑制胶质母细胞瘤进程。它们的组合益处归因于协同激活自噬。
-
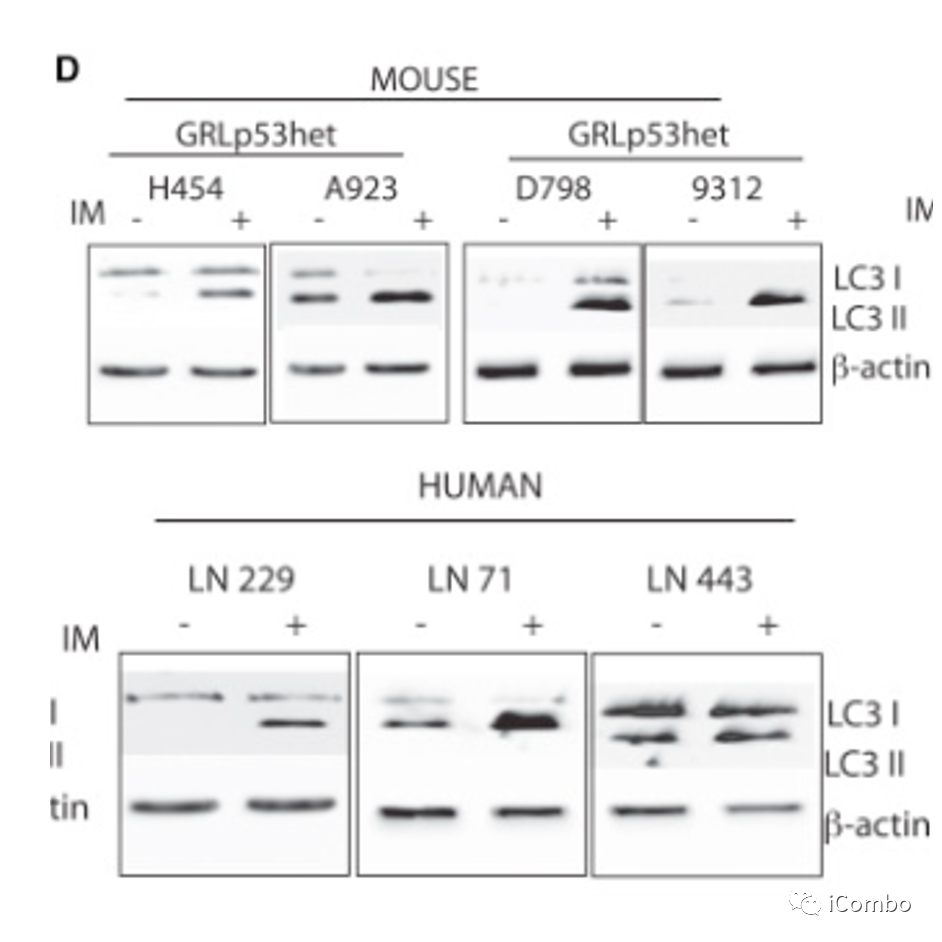
TCA可以促进胶质母细胞瘤的自噬
-
研究中筛选了临床上批准的用于影响自噬的药物,找出了能够增强丙咪嗪诱导的自噬相关细胞死亡的药物—TIC。
-
IM+TIC组合通过升高的cAMP信号传导诱导AACD的协同效应的机制示意图
作者设想,共同靶向独特的肿瘤促进机制以及自噬可以产生额外的治疗益处。作者专注于肿瘤脉管系统,推断IM联合VEGF通路抑制剂可能会有协同作用。
Key Experiments
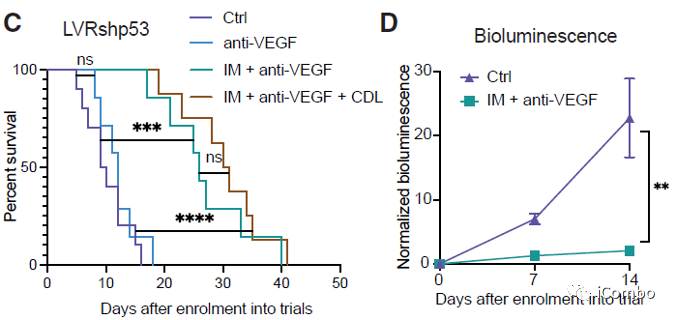
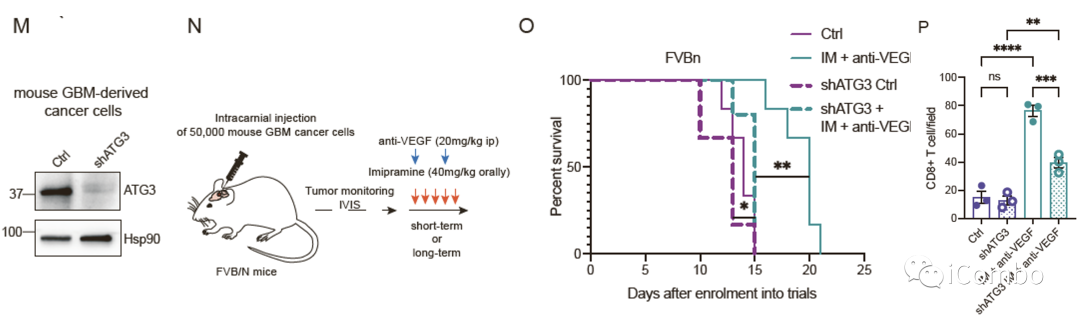
IM联合anti-VEGF显著抑制肿瘤生长,延长GBM小鼠的生存期
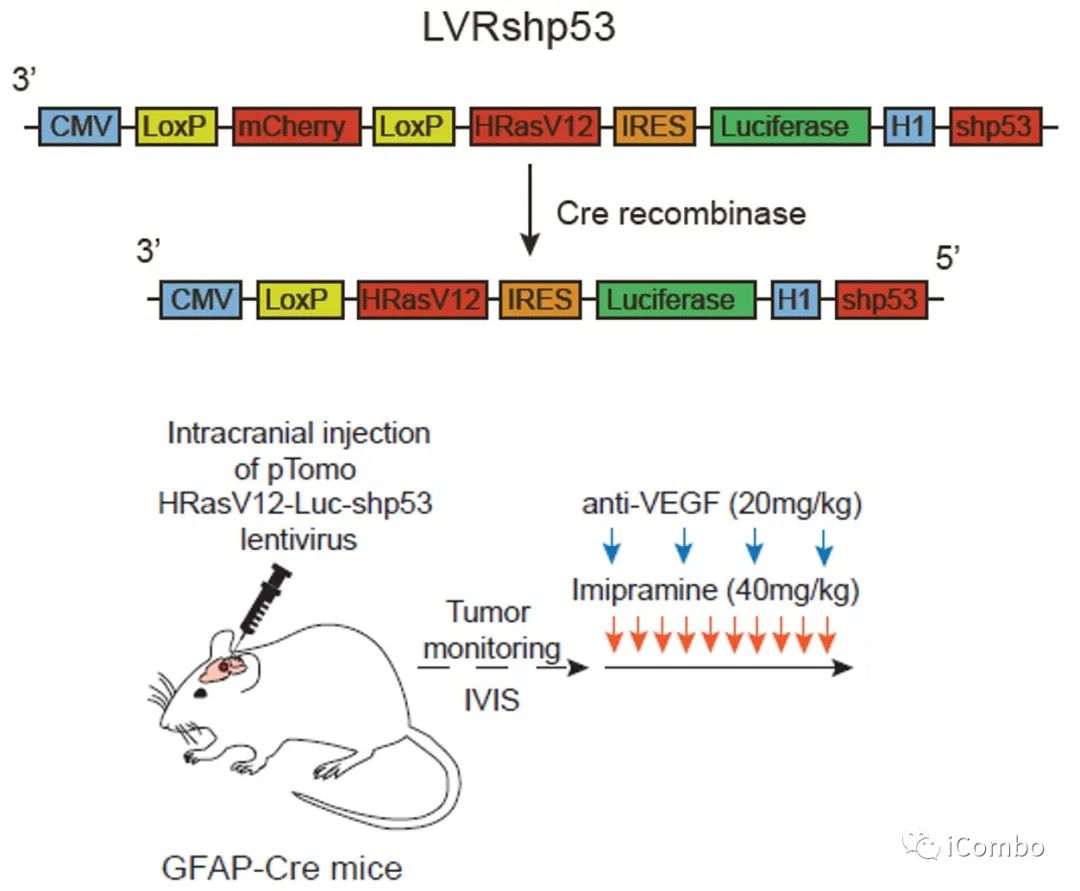
慢病毒诱导的胶质瘤小鼠模型的治疗示意图
Anti-VEGF:贝伐珠单抗类似物B20S
P2Y12抑制剂:氯吡格雷(CDL)

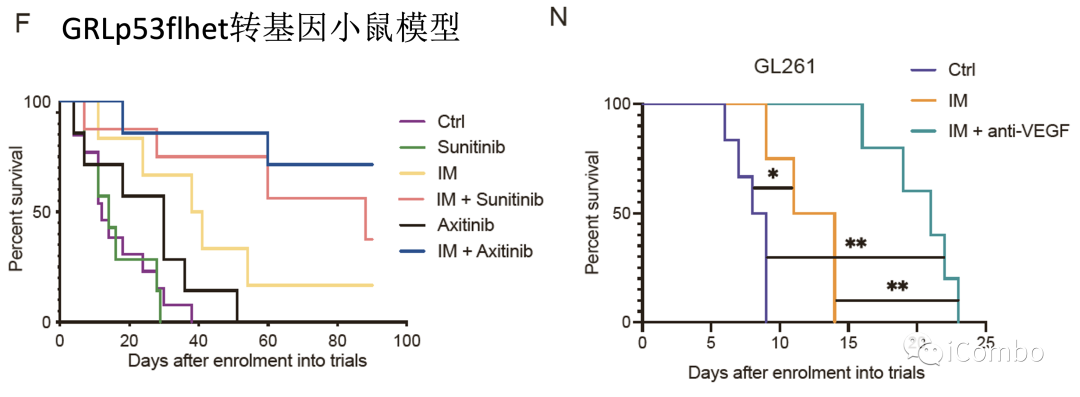
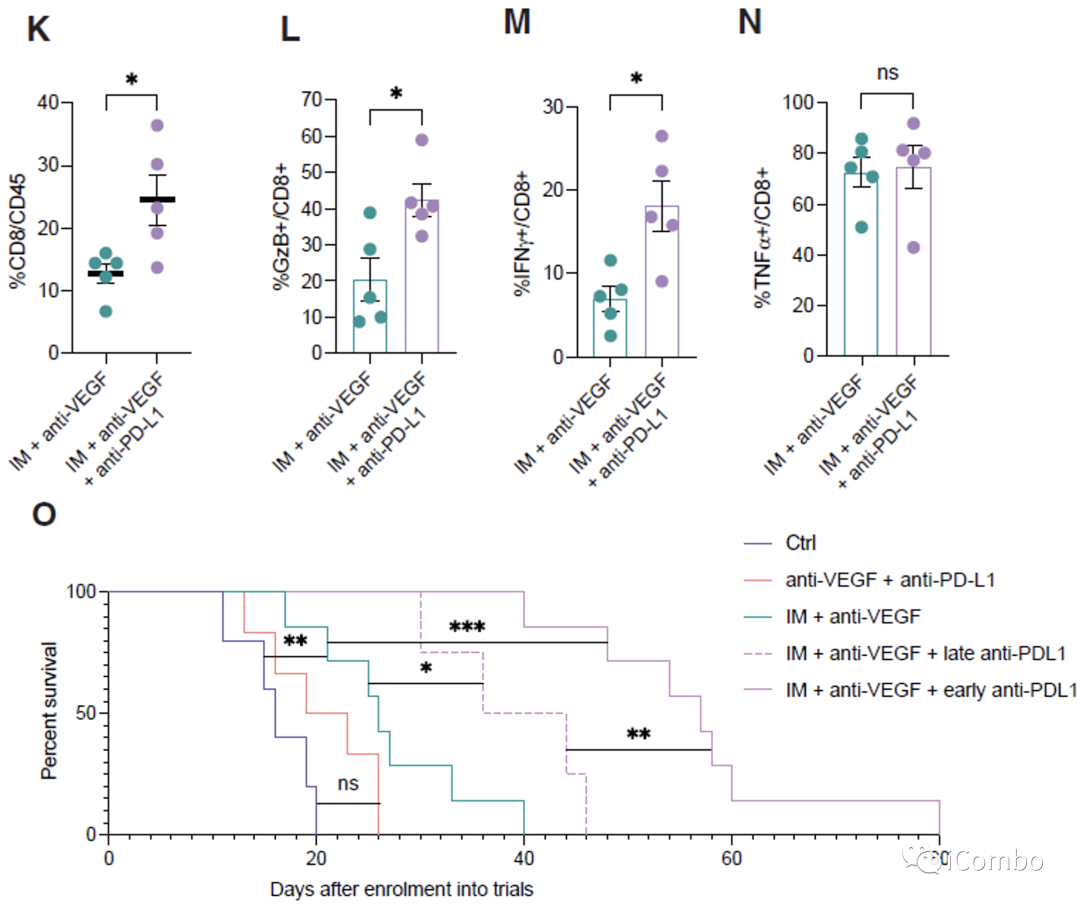
IM和VEGF抑制剂组合疗法可以激活免疫
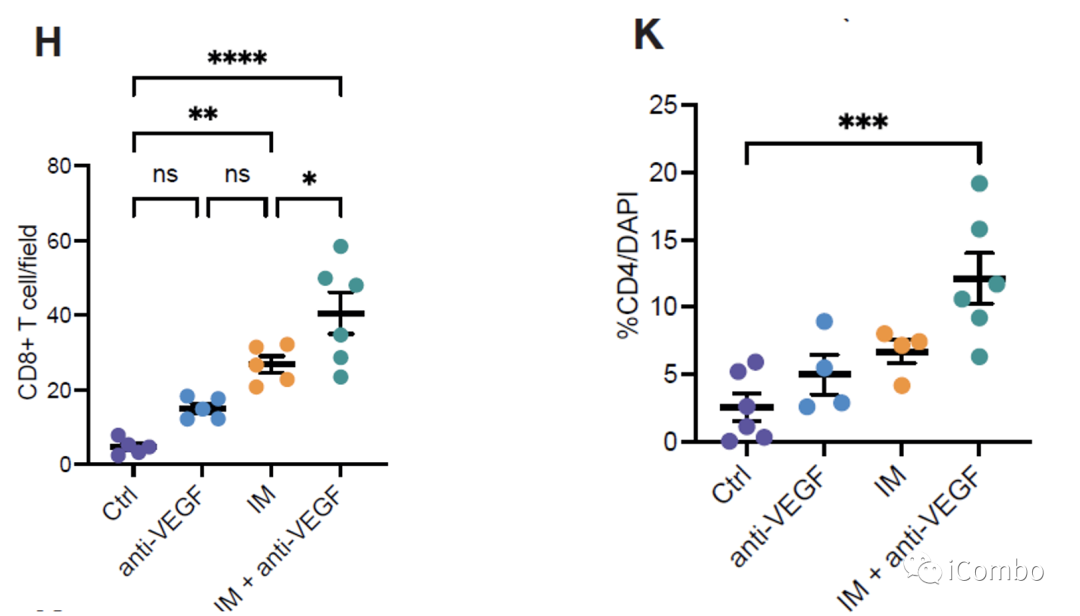
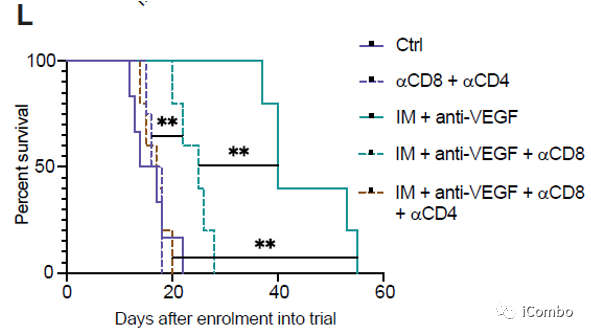
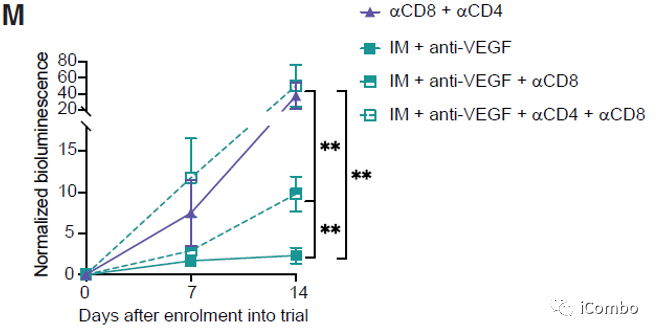
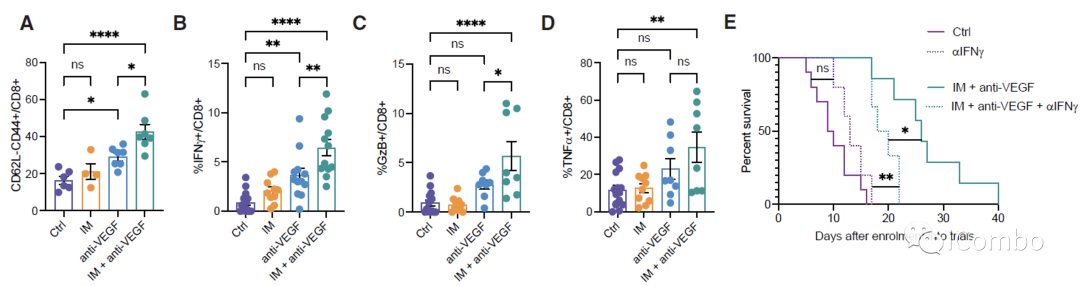
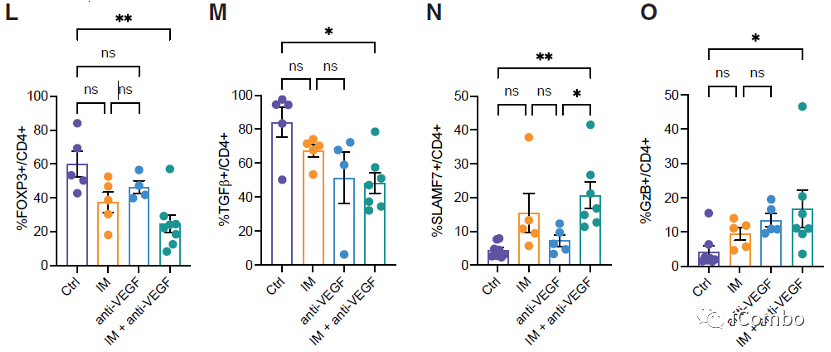
IM联合anti-VEGF激活自噬, 招募T细胞,促进免疫
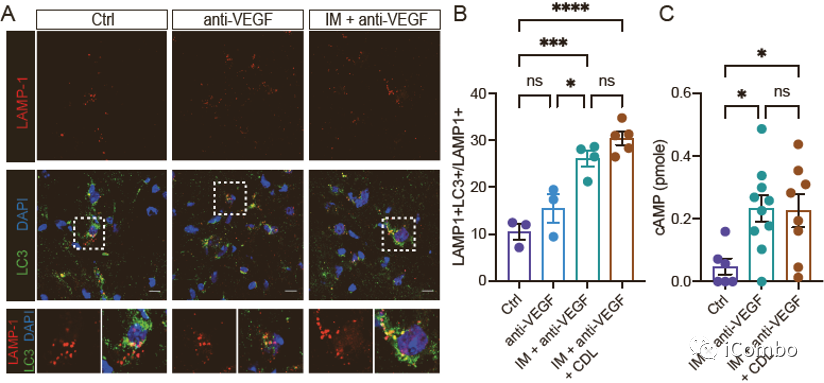
IM促进TAMs重塑,下调TAMs的M2型相关基因,上调M1型相关基因表达
研究表明,在胶质母细胞瘤中,单核细胞来源的巨噬细胞(MDMs)和小胶质细胞产生的肿瘤相关巨噬细胞(TAMs)与免疫抑制相关,促进肿瘤发生。
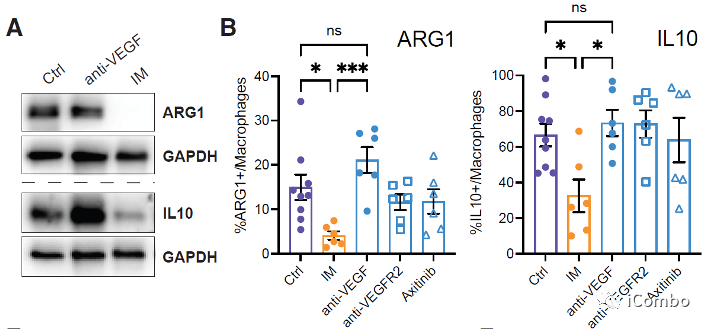
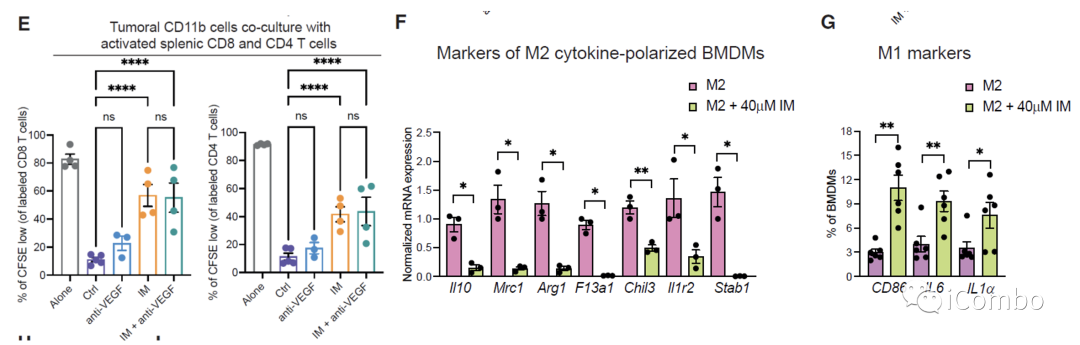
IM处理可以通过抑制组胺受体Hrh1,下调M2相关基因表达,重塑TAMs,促进肿瘤免疫

TFP(HRH1拮抗剂)
HRH1低表达及使用抗组胺药与GBM患者更好的生存率相关
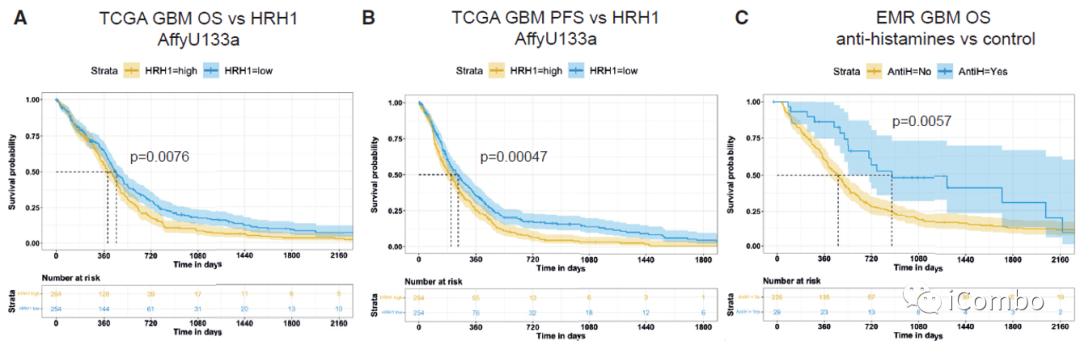
胶质母细胞瘤患者的数据库分析结果显示,更低的HRH1表达水平与更长的OS和PFS相关,并且在疾病之前和期间接受了抗组胺治疗的患者预后更好。
CXCL9和CXCL10在IM联合anti-VEGF治疗中上调
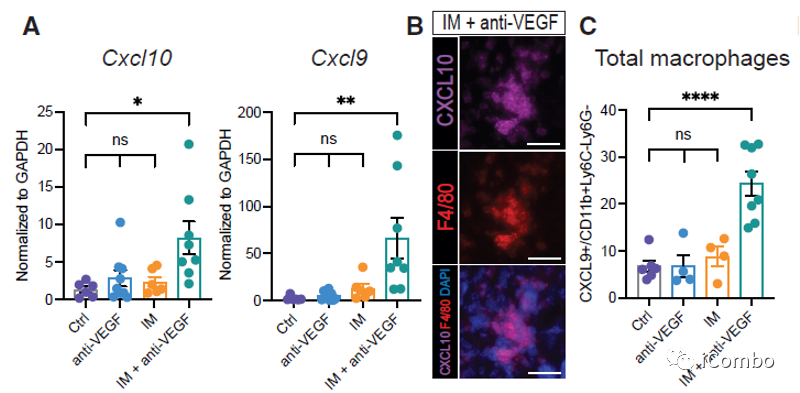
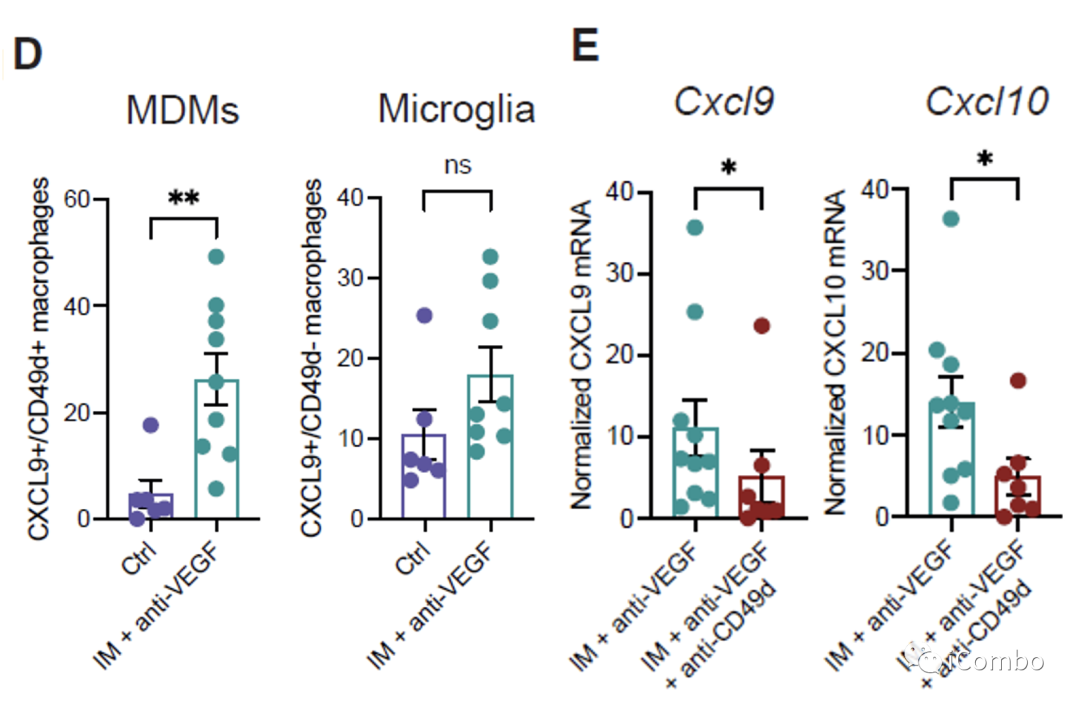
CXCL9/10-CXCR3轴有助于增强T细胞募集到GBM肿瘤中
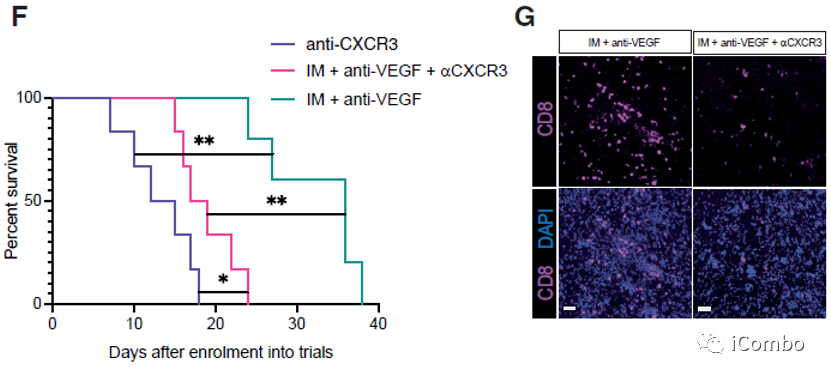
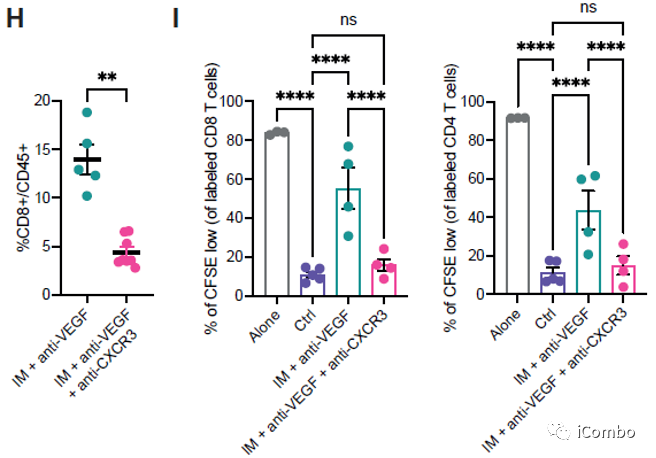
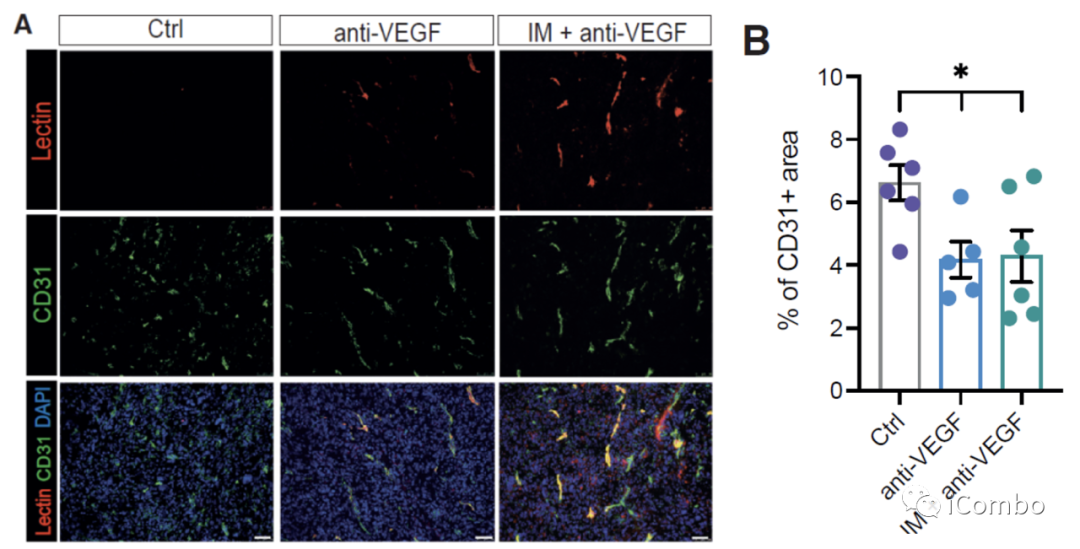
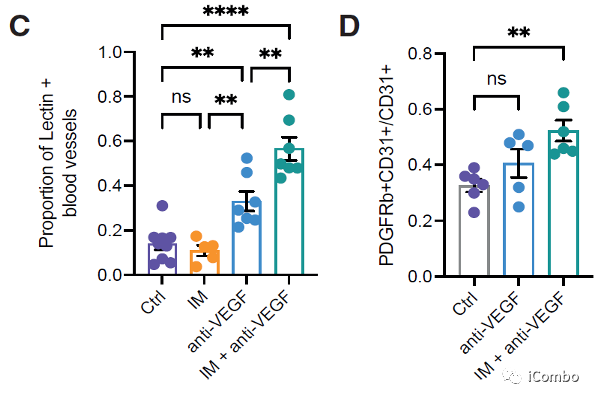
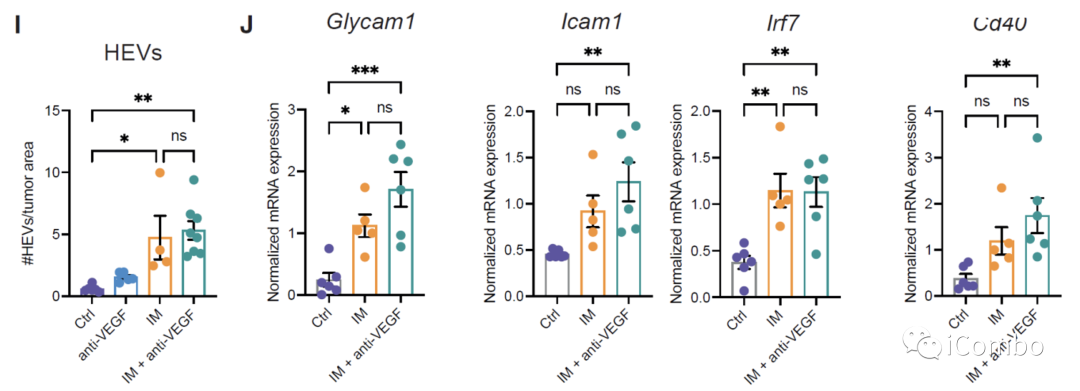
IM联合anti-VEGF减少肿瘤血管分布,重塑脉管系统,诱导HEVs形成,招募淋巴细胞
在复发的肿瘤中,PD-L1表达水平显著上升
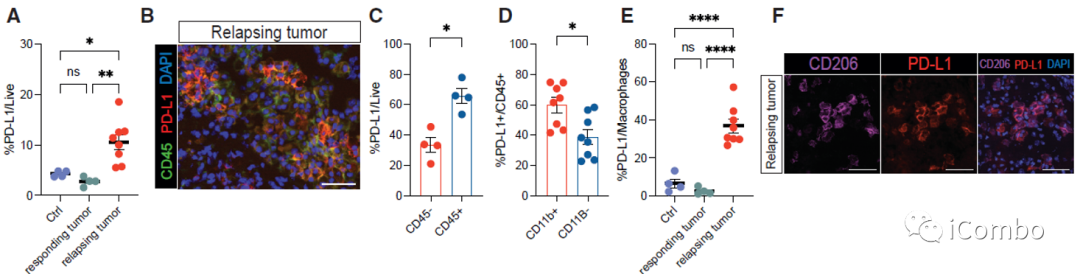
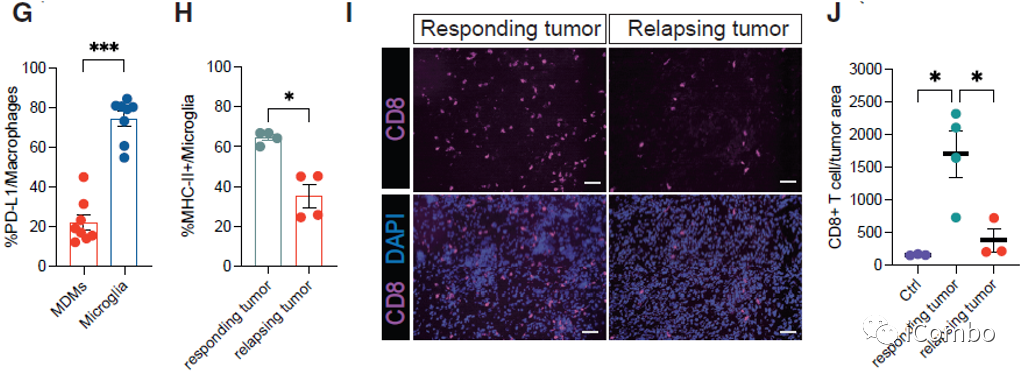
PD-L1抗体与IM和VEGF抑制剂联用可进一步提高疗效
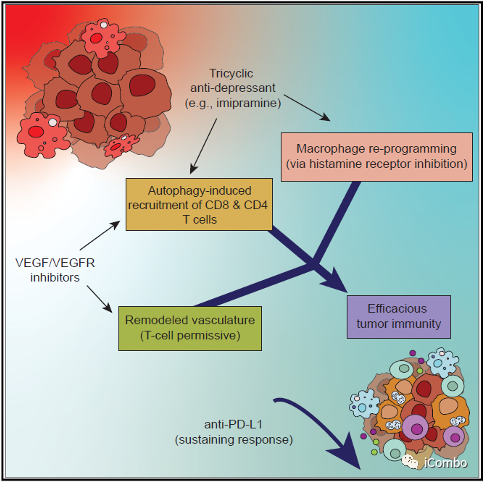
Take home message
亮点:
-
丙咪嗪(IM)与 VEGF 抑制剂联用可抑制胶质母细胞瘤进展。
-
IM促进肿瘤细胞的自噬,招募T细胞,并且通过抑制组胺受体重塑肿瘤相关巨噬细胞。
-
VEGF抑制剂重塑脉管系统,诱导HEVs形成,招募淋巴细胞。
-
IM + 抗 VEGF 疗法使胶质瘤对抗 PD-L1 敏感,从而维持免疫力。
作者:iCombo
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言