【论着】| AK-HER2与化疗药物治疗HER2可促进乳腺癌患者的康复、体内有助于特征、安全性和免疫原性比较:一个多中心……
2024-03-31 中国癌症杂志 中国癌症杂志
本研究旨在评估AK-HER2与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者中的临床疗效、药代动力学、安全性和免疫原性的差异。
背景与目的:针对人表皮生长因子受体(human epidermal growth factor receptor 2,HER2)阳性转移性乳腺癌患者,曲妥珠单抗治疗能够延长患者总生存期,显著改善患者预后,但是原研曲妥珠单抗价格较高。生物类似药理论上具有相当的疗效和安全性。本临床试验旨在评估曲妥珠单抗生物类似药AK-HER2与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者中的疗效、药代动力学、安全性和免疫原性。方法:这项多中心、随机、双盲Ⅲ期临床试验在中国43个分中心开展。本研究遵从研究方案、赫尔辛基宣言阐明的伦理学原则和药物临床试验质量管理规范,获得医院医学伦理委员会批准,临床试验注册机构为国家药品监督管理局(临床试验批件号为2015L04224,临床试验登记号为CTR20170516)。在入组前获得了受试者的书面知情同意书。入组患者随机分配至AK-HER2组与对照组,分别接受AK-HER2或原研曲妥珠单抗(赫赛汀®,初始负荷剂量8 mg/kg,维持剂量6 mg/kg,每3周为1个治疗周期,总治疗时间为16个周期)与多西他赛(剂量75 mg/m2,治疗持续至少9个周期)联合治疗。本临床试验主要研究终点是第9个周期AK-HER2组与对照组的客观缓解率(objective response rate,ORR)。次要疗效终点包括ORR16、疾病控制率(disease control rate,DCR)、临床获益率(clinical benefit rate,CBR)、无进展生存期(progression-free survival,PFS)和1年生存率。本研究在第6个周期用药后,随机选择100例受试者(AK-HER2组∶对照组=1∶1)进行血样采集,采集时间点分别为输注45 min时(即给药结束)、给药结束后第4、8、24、72、120、168、336、504 h。采集后血样进行PK参数(PK parameter set,PKPS)分析。其他评估指标包括安全性和免疫原性评估。结果:2017年9月—2021年3月期间共有550例HER2阳性转移性乳腺癌患者入组该临床试验。AK-HER2组(n=275)和对照组(n=272)的ORR9分别为试验组受试者(n=237)达CR或PR的有129例,ORR9为54.4%,对照组受试者(n=241)达CR或PR的有134例,ORR9为55.6%。AK-HER2组与对照组的ORR9比率为97.9%[90%置信区间(confidence interval,CI):85.4%~112.2%,P=0.784]差异无统计学意义。在所有次要疗效终点中,两组均未观察到差异有统计学意义。本研究进行了AK-HER2组和对照组药代动力学(pharmacokinetics,PK)参数的均值比值分析,结果显示,两种药物的药代动力学特征相似。原研曲妥珠单抗治疗导致药物减量或暂停的治疗期间出现的不良事件(treatment emergent adverse event,TEAE)发生率,AK-HER2组为3.6%(10例),对照组为8.1%(22例),两组差异有统计学意义(P=0.027)。AK-HER2组发生率较对照组明显减少,其余组间差异均无统计学意义。抗药抗体(anti-drug antibody,ADA)与中和抗体(neutralizing antibody,NAB)阳性率组间差异均无统计学意义(P=0.385和P=0.752)。结论:在HER2阳性转移性乳腺癌患者中,AK-HER2与参照药原研曲妥珠单抗的疗效、药代动力学、安全性和免疫原性 相当。
[关键词] 乳腺癌;曲妥珠单抗;AK-HER2;疗效;药代动力学;安全性
[Abstract]Background and purpose: For patients with human epidermal growth factor receptor 2 (HER2)-positive metastatic breast cancer, trastuzumab treatment can prolong the overall survival and significantly improve the prognosis of patients. However, the reference original research trastuzumab (Herceptin®) is more expensive. Biosimilars have comparable efficacy and safety profiles while increasing patient access to treatment. This clinical trial aimed to evaluate the efficacy, pharmacokinetics, safety and immunogenicity of the trastuzumab biosimilar AK-HER2 compared to trastuzumab (Herceptin®) in patients with HER2-positive metastatic breast cancer. Methods: This multi-center, randomised, double-blind phase Ⅲ clinical trial was conducted in 43 subcenters in China. This study complied with the research protocol, the ethical principles stated in the Declaration of Helsinki and the quality management standards for drug clinical trials. It was approved by the hospital's medical ethics committee. The clinical trial registration agency is the State Food and Drug Administration (clinical trial approval number: 2015L04224; clinical trial registration number: CTR20170516). Written informed consent was obtained from subjects before enrollment. Enrolled patients were randomly assigned to the AK-HER2 group and the control group, respectively receiving AK-HER2 or trastuzumab (initial loading dose 8 mg/kg, maintenance dose 6 mg/kg, every 3 weeks as a treatment cycle, total treatment time is 16 cycles) in combination with docetaxel (75 mg/m2, treatment duration is at least 9 cycles). The primary endpoint of this clinical trial was the objective response rate (ORR9) between the AK-HER2 group and the control group in the 9th cycle. Secondary efficacy endpoints included ORR16, disease control rate (DCR), clinical benefit rate (CBR), progression-free survival (PFS) and 1-year survival rate. In this study, 100 subjects (AK-HER2 group to control group=1:1) were randomly selected for blood sample collection after the 6th cycle of medication, The collection time points were 45 minutes after infusion (the end of administration), 4, 8, 24, 72, 120, 168, 336, and 504 hours after the end of administration. After collection, blood samples were analyzed by PK parameter set (PKPS). Other evaluation parameters included safety and immunogenicity assessment. Results: A total of 550 patients with HER2-positive metastatic breast cancer were enrolled in this clinical trial between Sep. 2017 and Mar. 2021. In the AK-HER2 group (n=237), 129 subjects in the experimental group achieved complete response (CR) or partial response (PR), and the ORR9 was 54.4%. There were 134 subjects in the control group (n=241) who achieved CR or PR, and the ORR9 was 55.6%. The ORR9 ratio between the AK-HER2 group and the control group was 97.9% [90% confidence interval (CI): 85.4%-112.2%, P=0.784], which was not statistically significant. In all secondary efficacy endpoints, no statistically significant differences were observed between the two groups. We conducted a mean ratio analysis of pharmacokinetics (PK) parameters between the AK-HER2 group and the control group, and the results suggested that the pharmacokinetic characteristics of the two drugs are similar. The incidence of treatment emergent adverse event (TEAE) leading to drug reduction or suspension during trastuzumab treatment was 3.6% (10 cases) in the AK-HER2 group and 8.1% (22 cases) in the control group. There was statistically significant difference between the two groups (P=0.027). The incidence rate was significantly lower in the AK-HER2 group than in the control group, and there was no statistically significant difference among the other groups. The differences in the positive rates of anti-drug antibodies (ADA) and neutralizing antibodies (NAB) between groups were of no statistical significance (P=0.385 and P=0.752). Conclusion: In patients with HER2-positive metastatic breast cancer, AK-HER2 was comparable to the trastuzumab (Herceptin®) in terms of drug efficacy, pharmacokinetics, safety and immunogenicity.
[Key words] Breast cancer; Trastuzumab; AK-HER2; Efficacy; Pharmacokinetics; Safety
世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的数据显示,2020年全球乳腺癌新发病例约230万和死亡病例68.5万[1]。2020年中国乳腺癌新发病例数高达41.6万,死亡病例数高达11.7万,乳腺癌已成为中国女性肿瘤相关死亡率最高的恶性肿瘤[2]。中国女性乳腺癌的发病率与死亡率特点[3]如下:① 发病年龄趋向年轻化。中国人群初诊时年龄为40~50岁[4-6];② 不同地区乳腺癌生存率差异大。例如农村与城市比较,乳腺癌患者的5年生存率差异超过20%(55.9% vs 77.8%)[7];③ 不同地区乳腺癌复发率不同。农村患者复发率高于城市患者(41.3% vs 34.8%)[8],这些差异在一定程度上可归因于健康意识差距、社会经济差异、医疗资源不均以及不同地区诊疗水平参差不齐[9-10]。
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性乳腺癌在全部乳腺癌中占有较高比例,针对HER2阳性转移性乳腺癌患者,曲妥珠单抗治疗能够延长患者总生存期,显著改善患者预后,相比之下,没有接受曲妥珠单抗治疗的患者中,部分患者出现疾病快速进展,甚至死亡[11-15]。但是原研曲妥珠单抗价格较高。生物类似药理论上具有相当的疗效和安全性。本临床试验旨在评估曲妥珠单抗生物类似药AK-HER2与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者中的疗效、药代动力学、安全性和免疫原性。
生物类似药与已批准的参照药相比,在临床安全性或有效性方面差异无统计学意义[15]。Ⅰ期临床试验表明,AK-HER2与原研曲妥珠单抗在健康志愿者中的药代动力学、安全性和免疫原性相当[16]。基于此,本研究旨在评估AK-HER2与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者中的临床疗效、药代动力学、安全性和免疫原性的差异。
1 资料和方法
1.1 研究方案
本研究是多中心、随机、双盲的Ⅲ期临床试验,旨在评估AK-HER2在HER2阳性转移性乳腺癌患者中的疗效、 安全性及体内代谢特征。该研究在中国43个分中心开展,时间为2017年9月—2021年3月,共550例乳腺癌患者纳入本研究。本研究遵从注册的研究方案、赫尔辛基宣言阐明的伦理学原则和药物临床试验质量管理规范,获得各医院医学伦理委员会批准,临床试验注册机构为国家药品监督管理局(临床试验批件号为2015L04224,临床试验登记号为CTR20170516)。在入组前获得了受试者的书面知情同意书。入组患者筛选流程见图1。
1.1.1 入组标准
① 患者年龄≥18岁;② 组织学或细胞学检查证实患有乳腺癌;③ 东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)表现状态评分为0~1;④ 其他关键入选标准包括HER2阳性及雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PgR)状态;⑤通过影像学检查评估的可测量病灶;⑥ 正常(在机构正常范围内)左心室射血分数(left ventricular ejection fraction,LVEF)及器官功能良好。
1.1.2 排除标准
①既往或正在治疗(全身化疗,或靶向药物,或除内分泌治疗外的任何其他抗癌药物);② 转移性乳腺癌;③ 存在或疑似存在脑转移或任何其他中枢神经系统转移;④ 存在需要治疗的具有临床意义的活动性感染;⑤ 未得到控制的高血压或不稳定型心绞痛;⑥ 有蒽环类药物治疗史且达到某一累积剂量(图1)。筛选出550例HER2阳性转移性乳腺癌患者,按ER/PgR状态1∶1比例随机分配至AK-HER2组和对照组,应用临床电子化中央随机系统(DAS for IWRS)分配随机号。547例患者被纳入疗效分析(3例未接受研究药物治疗的患者未纳入分析),275例患者接受AK-HER2治疗,272例患者接受原研曲妥珠单抗(赫赛汀®)治疗。
1.1.3 随机研究方法
本研究采用动态随机方法,符合筛选入组条件的受试者,根据体内激素受体状态,将入组患者随机分配至2个治疗组(试验组和对照组)并产生随机号,随机号即作为试验盲法条件下该受试者的唯一编号。本研究对随机编码的权限进行严格控制。研究过程中每例受试者接受何种治疗不会向研究者、研究中心人员、受试者本人以及申办者公开。由于试验药与对照药的内包装不同,每个临床研究中心都设有非盲团队,他们为每例受试者复溶研究药物。药物复溶后,非盲人员将在输液袋/瓶上做相应标记,标记中不得透露任何有关药物组别的信息,因此研究团队及申办方均将无法获知输液袋/瓶内含有何种药物。受试者随机化结束,从中央随机系统 (interactive web response system,IWRS)导出随机表(一级盲底),一式二份提交申办方,分别封存在申办方和临床研究负责单位。二级盲底在编盲时产生提交。入组患者的人口学和基线特征见表1。
1.1.4 治疗方法
在第1个周期的第1天,患者接受 AK-HER2或原研曲妥珠单抗静脉滴注,起始量为8 mg/kg,90 min完成,每3周为1个周期,直至第16个周期结束。多西他赛初始剂量75 mg/m2,在第1个周期的第2天首次静脉滴注,滴注时间为60 min,后续治疗均与AK-HER2或原研曲妥珠单抗联合用药,持续至少9个周期,直至患者发生疾病进展或不可耐受的药物相关毒性反应。研究设计见图1。
1.1.5 治疗效果与不良事件评价标准
受试者最终疗效根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1 版[17]和独立盲态审核认定。这项研究的主要疗效终点是第9个周期治疗结束时,患者客观缓解率(objective response rate,ORR)即ORR9,包括完全缓解率(complete response rate,CR)和部分缓解率(partial response rate,PR)。次要疗效终点为16个周期治疗结束时,患者ORR16、疾病控制率(disease control rate,DCR)、临床获益率(clinical benefit rate,CBR)、无进展生存期(progression-free survival,PFS)和1年生存率。
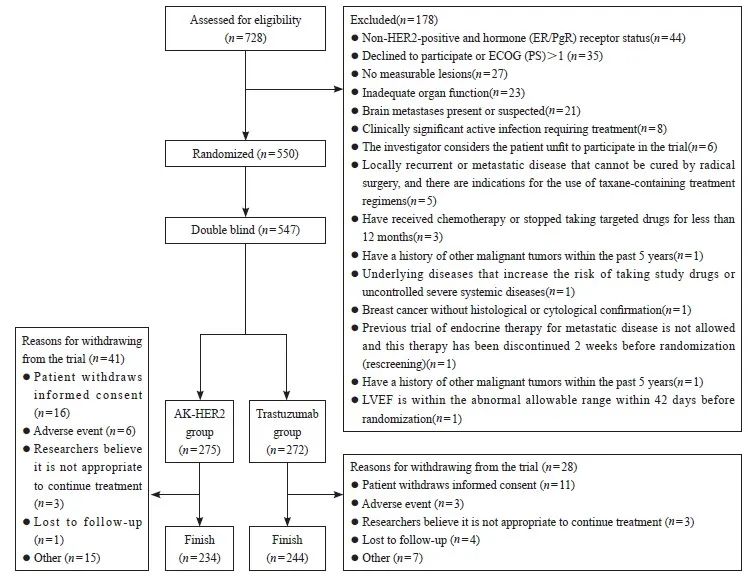
图1 患者筛选流程图
Fig. 1 Patient flow diagram
1.2 影像学检查
本研究受试者在研究过程中接受全身增强电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)检查。患者治疗效果评估依据实体瘤疗效评价标准,结合盲态独立中心评估(blinded independent central review,BICR)标准。在首次给药后第6、12、18、27、36、45周及治疗结束时等7个不同时间点均进行一次疗效评估。在筛查期和研究期间,受试者通过CT或MRI增强扫描评估病情,影像学检查包括:① 胸部和腹部(包括肝、脾和肾上腺等)CT或MRI扫描;② 临床疑似出现中枢神经系统(central nervous system,CNS)转移时,增加头颅和(或)脊椎CT或MRI扫描;③ 如果骨病灶出现进展或出现新发骨病灶,则需要再次进行X线扫描;④ 如果受试者出现新发皮肤(或皮下)病灶,则通过CT/MRI等影像学检查进行监测。并通过超声心动图(echocardiogram,ECHO)或多门核素血管造影术(multigated radionuclide angiography, MUGA)对心脏功能进行评估。
1.3 不良事件评估
本研究评估治疗期间出现的不良事件(treatment emergent adverse event,TEAE)、严重不良事件(serious adverse event,SAE)和特殊关注的不良事件(adverse event of special interest,AESI)的发生率和严重程度,探讨AK-HER2和原研曲妥珠单抗的安全性和耐受性。所有不良事件使用监管活动医学词典(medical dictionary for regulatory activities,MedDRA)编码,并依照国家癌症研究所不良事件通用术语标准第4.03版(National Cancer Institute Common Terminology Criteria for Adverse Events v4.03,NCI-CTCAE v4.03)进行分级。
1.4 药代动力学评估
本研究在第1、3、4、5、6、10、13、16个周期时,分别在药物输注前及末次访视(end of treatment,EOT)时,采集血样进行药代动力学(pharmacokinetics,PK)分析。本研究在第6个周期用药后,随机选择100例受试者(AK-HER2组∶对照组=1∶1)进行血样采集,采集时间点分别为输注45 min时(即给药结束)、给药结束后第4、8、24、72、120、168、336、504 h。采集后血样进行PK参数(PK parameter set,PKPS)分析。PK参数分析采用PKPS分析方法,由非房室模型计算各受试者的药代动力学参数,包括:药物稳态峰浓度(steady-state maximum concentration,Cmax,ss)、分布容积(volume of distribution,Vz)、末端消除半衰期(elimination half life,T½)、静脉给药稳态清除率(steady-state clearance,CLss)和给药间隔内血药浓度-时间曲线下面积(area under the plasma concentration-time curve from time 0 to last time quantifiable concentration,AUC0-τ)等。采用线性模型进行不同药物变异模型的分析。血药浓度(c)-时间(t)数据分析采用药代动力学浓度集(pharmacokinetics concentration set,PKCS)。
采用配体结合式(ligand binding assays,LBA)的定量分析方法测定血清中曲妥珠单抗药物浓度。采集的血样基于抗药抗体(anti-drug antibody,ADA)、中和抗体(neutralizing antibody,NAB)和桥式酶联免疫吸附法(bridging-ELISA)分析方法评估受试者血清免疫原性特征。
1.5 统计学处理
总样本量鉴于文献报道的ORR数据[18-21],假设两组治疗6个月的主要疗效指标ORR的保守估计值为60%,根据《曲妥珠单抗生物类似药临床试验指导原则(征求意见稿)》(CDE,2020),使用AK-HER2与原研曲妥珠单抗比率的等效性限度[0.8,1.25],采用双向单侧t检验,单侧α=0.05,β=0.20,AK-HER2组与对照组按1∶1比例分配病例,采用PASS 14.0计算,考虑13.0%的脱落率,本研究计划纳入540例受试者。
采用χ2检验比较组间ORR9(95% CI),均进行符合方案集(per protocol set,PPS)和全分析集(full analysis set,FAS)分析。采用χ2检验或Fisher精确概率法比较ORR16、CBR和DCR组间差别。采用Kaplan-Meier的方法分析PFS,分别列出四分位数、中位数和删失率,组间比较采用log-rank检验。在次要疗效指标敏感性分析中,PFS采用Cox比例风险回归模型估计组间风险比并计算其95% CI(Wald法)。在PFS与生存期(overall survival,OS)数据分析分别采用分层log-rank检验计算P值,分层COX回归计算HR,分层因素为来源于IWRS的激素受体水平;采用不分层log-rank检验计算P值,不分层Cox回归计算HR。
2 结 果
2.1 药物暴露
AK-HER2组和对照组的随访持续时间均为48周。AK-HER2和原研曲妥珠单抗平均暴露治疗天数分别为197.6和198.2 d,差异无统计学意义(P=0.950);药物平均暴露剂量分别为3 850.49和3 863.07 mg,差异无统计学意义(P=0.945)。AK-HER2组和对照组中,多西他赛平均暴露治疗天数分别为167.0和159.5 d,差异无统计学意义(P=0.369);药物平均暴露剂量分别为1 063.081和1 023.048 mg,差异无统计学意义(P=0.410)。
2.2 疗效分析
采用独立评审委员会(Independent Review Committee,IRC)标准评估数据,PPS分析研究结果提示,AK-HER2组(n=275)与对照组(n=241)的ORR9比为97.9%(54.4% vs 55.6%,90% CI:85.4%~112.2%,P=0.784;表2);FAS分析AK-HER2组与对照组的ORR9比为95.4%(49.1% vs 51.5%,90% CI:82.9%~109.7%,P=0.631;表2)。研究者评估,PPS分析研究结果表明,AK-HER2组与对照组的ORR9比为98.6%(54.4% vs 55.2%,90% CI:86.0%~113.1%,P=0.843);FAS分析结果表明,AK-HER2组与对照组的ORR9比为96.1%(50.5% vs 52.6%,90% CI:83.9%~110.2%,P=0.664;表2)。
次要疗效终点分析中,AK-HER2组受试者ORR16为51.6%(95% CI:45.6%~57.7%),对照组ORR16为 52.2% ( 95% CI :46.1%~58.3%),两组间差异无统计学意义。AK-HER2组中,受试者达CR、PR或疾病稳定(stable disease,SD)有248例,受试者DCR为90.2%(95% CI:86.0%~93.4%)。对照组中,受试者达CR、PR或SD有241例,受试者DCR为88.6%(95% CI:84.2%~92.1%),两组间比较,组间差异无统计学意义(P=0.549)。AK-HER2组达CR、PR或持续SD(SD≥24周)的受试者共159例,受试者CBR为57.8%(95% CI:51.7%~63.7%)。对照组164例受试者达CR、PR或持续SD(SD≥24周),受试者CBR为60.3%(95% CI:54.2%~66.2%),两组间比较,组间差异无统计学意义(P=0.556)。AK-HER2组中位PFS为10.3个月,对照组中位PFS为11.7个月。生存分析结果提示,AK-HER2组1年生存率为99.3%(95% CI:97.1%~99.8%),对照组生存率为98.9%(95% CI:96.6%~99.6%,图2,表2)。
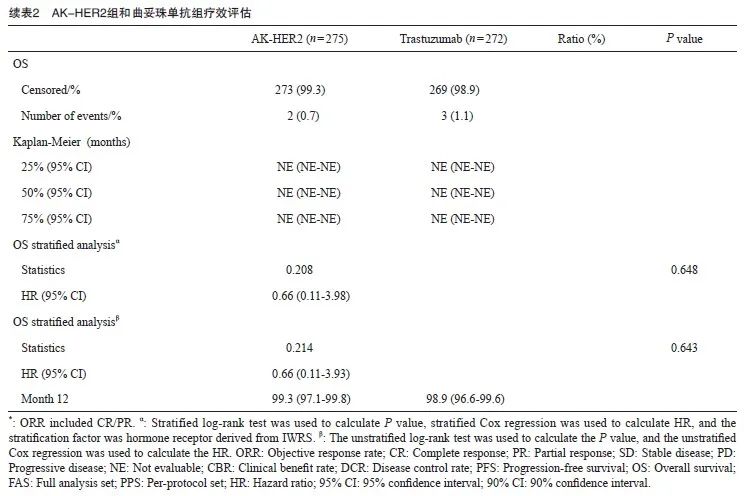
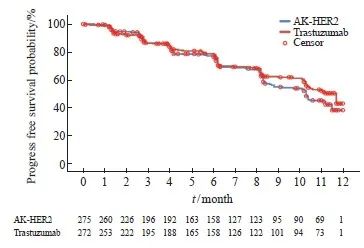
图2 Kaplan-Meier估计图(IRC评估, FAS)显示AK-HER2组及对照组治疗的HER2阳性转移性乳腺癌患者的PFS
Fig. 2 Kaplan-Meier estimate plot (IRC assessment, FAS) showing PFS of patients with HER2-positive metastatic breast cancer treated in the AK-HER2 group and the trastuzumab group
2.3 药代动力学结果
采用PKCS分析AK-HER2组和对照组的AUC0-τ比率为97.87%(20 911.74 vs 21 366.27,90% CI:91.13%~105.12%),Cmax,ss比率为95.76%(90% CI:90.25%~101.59%),T½比率为98.75%(90% CI:91.05%~107.11%),CLss比率为102.21%( 90% CI :94.80%~110.20%),Vz比率为100.94%(90% CI:93.27%~109.23%),结果表明,AK-HER2组和对照组PK参数的几何均值比率及90% CI均在等效区间80.00%~125.00%内,组间差异无统计学意义。研究结果提示两种药物的药代动力学特征相似(表3,图3)。
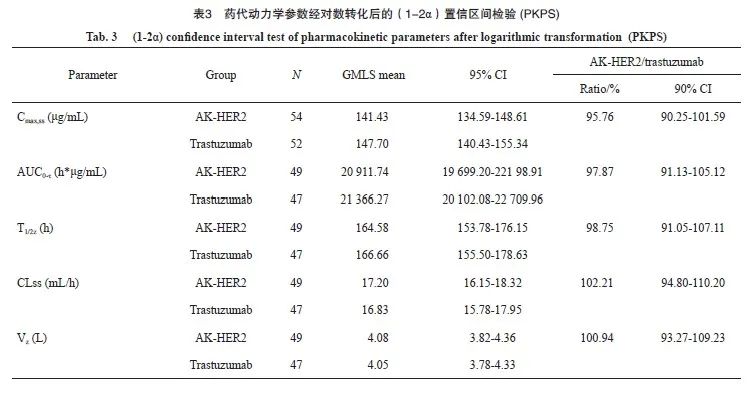
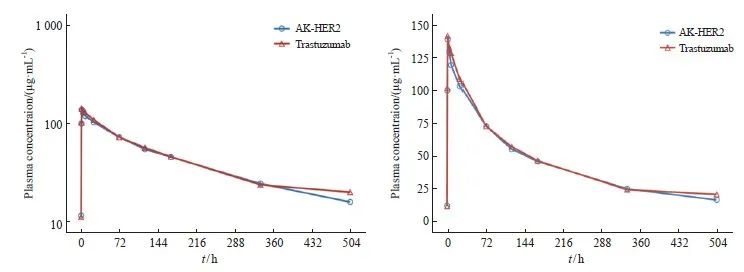
图3 受试者第6周期静脉输注6 mg/kg试验药+多西他赛或6 mg/kg对照药+多西他赛的平均血药浓度-时间图(Mean+SD)(PKCS)
Fig. 3 Average plasma concentration-time chart of subjects receiving intravenous infusion of 6 mg/kg AK-HER2 + docetaxel or 6 mg/kg trastuzumab + docetaxel in the 6th cycle (Mean+SD)(PKCS)
2.4 免疫原性结果
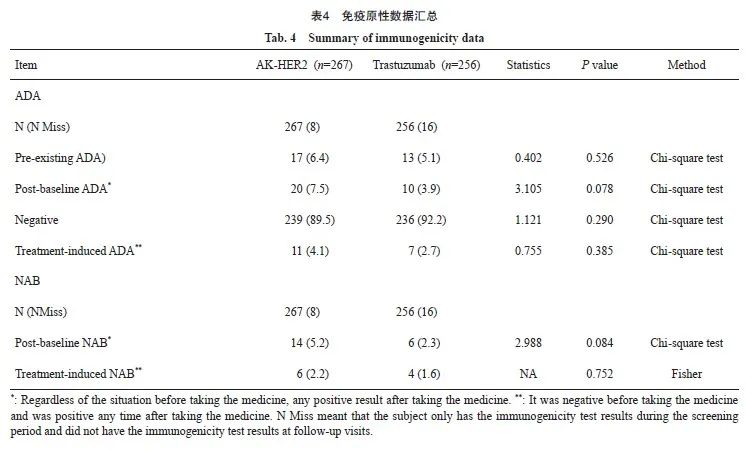
本研究中,AK-HER2组11例(4.1%)患者ADA阳性,对照组有7例(2.7%)患者ADA阳性。采用χ2检验分析两组患者ADA阳性率差异,结果显示,差异无统计学意义(P=0.385)。AK-HER2组有6例(2.2%)患者NAB阳性,对照组有4例(1.6%)患者NAB阳性。采用Fisher检验分析两组NAB阳性率差异,结果显示,差异无统计学意义(P=0.752,表4)。
2.5 安全性结果
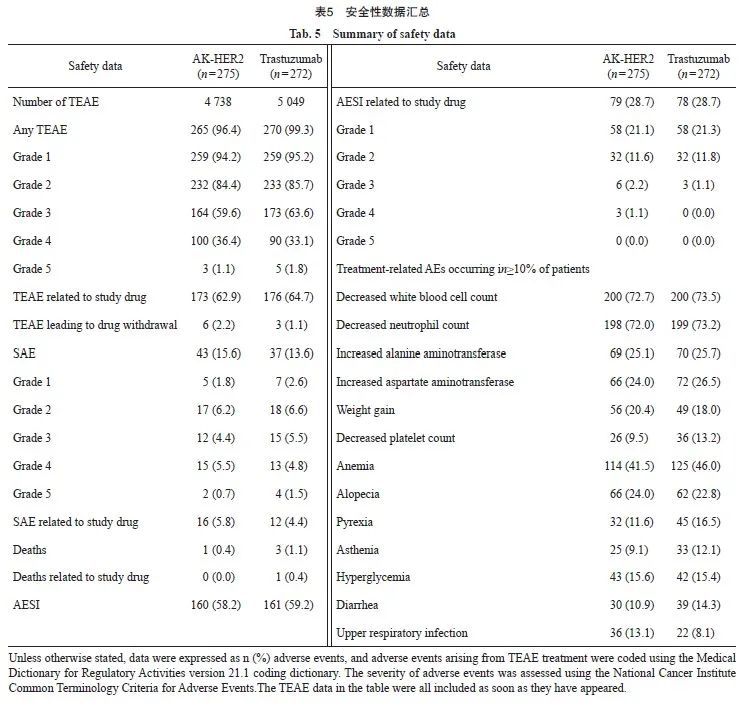
在AK-HER2组和对照组中,患者TEAE的发生率分别为96.4%和99.3%,两组患者TEAE发生率χ2检验,差异有统计学意义(P=0.021)。两组受试者SAE的发生率分别为15.6%和13.6%,而AESI的发生率分别为58.2%和59.2%。与对照组相比,AK-HER2组5级TEAE和SAE发生率较低,两组受试者均无一例发生5级AESI。AK-HER2组仅1例(0.4%)发生致死性TEAE(4级),而对照组有3例(1.1%)发生致死性TEAE(5级),其中1例(0.4%)与曲妥珠单抗药物治疗相关,1例(0.4%)与多西他赛药物治疗相关。曲妥珠单抗治疗导致药物减量或暂停的TEAE发生率,AK-HER2组为3.6%(10例),对照组为8.1%(22例),差异有统计学意义(P=0.027)。AK-HER2组发生率较对照组明显减少(表4)。
本研究分析了AK-HER2组与对照组最常见TEAE的发生率,包括白细胞减少、中性粒细胞减少、贫血、丙氨酸氨基转移酶升高和天冬氨酸氨基转移酶升高等。AK-HER2组与对照组不同TEAE发生情况分别为:白细胞计数减少(72.7% vs 73.5%)、贫血(41.5% vs 46.0%)、血小板减少(9.5% vs 13.2%)、中性粒细胞减少(72.0% vs 73.2%)、丙氨酸氨基转移酶升高(25.1% vs 25.7%)和天冬氨酸氨基转移酶升高(24.0% vs 26.5%)。研究结果提示,以上TEAE发生率AK-HER2组均较对照组略低。其他药物不良反应观察结果显示,对照组出现1例输液部位过敏反应,AK-HER2组尚无输液不良反应(表5)。AK-HER2组与对照组比较,AK-HER2组发热(11.6% vs 16.5%)、乏力(9.1% vs 12.1%)和腹泻(10.9% vs 14.3%)的发生率较对照组明显减少,但是上呼吸道感染的发生率AK-HER2组比对照组略高(13.1% vs 8.1%)。
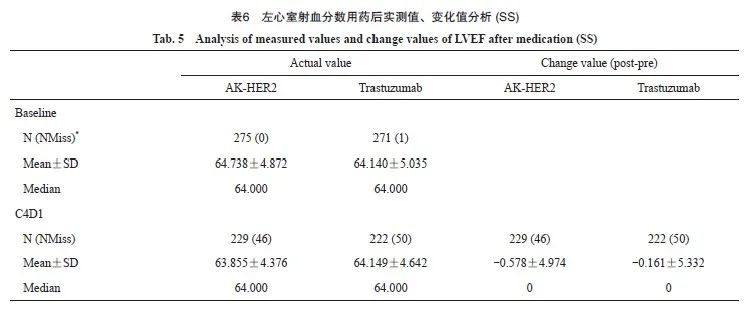
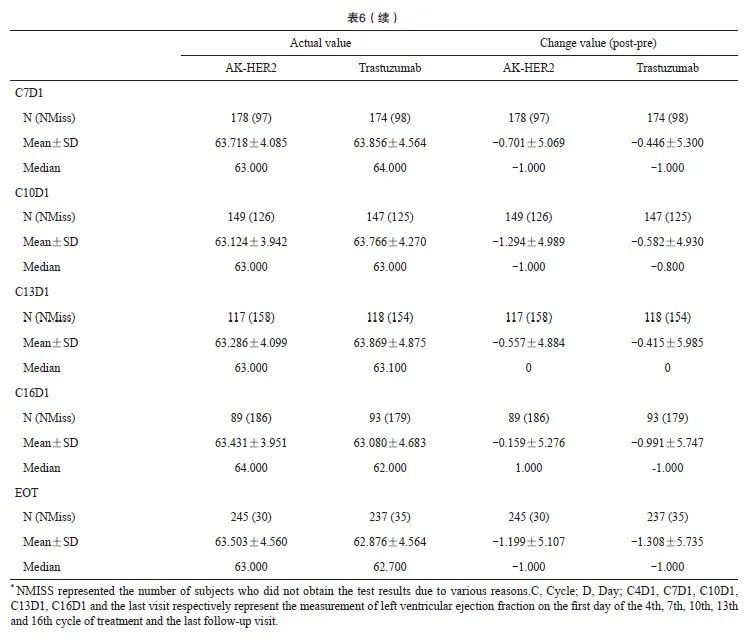
本研究对药物的心脏毒性系统性评估结果显示,AK-HER2组与对照组的左心室射血分数(left ventricular ejection fractions,LVEF)基线以及C4D1均为64.0%,C16D1中位数分别为64.0%与62.0%。在EOT时间点,AK-HER2组与对照组的LVEF中位数分别为63.0%与62.7%。基线、C4D1、C7D1、C10D1、C13D1、C16D1和EOT等不同观察时间点,两组LVEF中位数差异无统计学意义(表6)。本研究结果显示,AK-HER2组与对照组药物的心脏毒性差异无统计学意义。
3 讨 论
本研究是随机、多中心、双盲的Ⅲ期临床试验,结果显示,AK-HER2和原研曲妥珠单抗在HER2阳性转移性乳腺癌的疗效具有等效性。研究结果还表明,PFS与生存率无论是否采用分层分析,其组间风险比差异均无统计学意义。
AK-HER2的Ⅰ期临床试验[16]结果表明,在健康的中国成年人中,AK-HER2与原研曲妥珠单抗的药代动力学和安全性相当。目前曲妥珠单抗及其部分生物类似药Ⅰ期临床研究中,入组患者均为健康男性,缺少健康女性志愿者的数据作为参考[22-25]。为了提供更加全面的人体药物代谢信息,AK-HER2的Ⅰ期临床试验将患者性别因素纳入考虑范畴,入组患者由64例男性和32例女性健康志愿者组成,因此该研究结果也具有更好的代表性和参考价值[16]。在本研究中设计取血点不同,我们密集采集9个点的血样,分别在第6个周期给药结束后第0、4、8、24、72、120、168、336和504 h。研究结果也表明,AK-HER2与原研曲妥珠单抗的药代动力学差异无统计学意义。综上所述,Ⅰ期健康男性与女性志愿者以及Ⅲ期HER2阳性乳腺癌患者的药代动力学参数AK-HER2组与对照组相比,生物等效性相当。
在药物不良反应方面,本研究结果显示, AK-HER2组比对照组TEAE发生率低,且AK-HER2组无一例药物致死病例发生[27]。曲妥珠单抗治疗导致药物减量或暂停的TEAE发生率,AK-HER2组发生率较对照组明显减少且组间差异有统计学意义,可能是发生例数较少所致。药物安全性数据显示,AK-HER2组患者肝脏毒性和血液毒性较低。AK-HER2组发热、乏力等不良事件发生率也较低,但是上呼吸道感染发生率较对照组略高。在今后用药过程中,应更加严密观察上呼吸道感染相关疾病发生的可能性。本研究通过ECHO或MUGA扫描评估心脏功能,结果显示,AK-HER2用药前后LVEF差值变化与原研曲妥珠单抗差异无统计学意义,AK-HER2的心脏毒性在可接受范围内。
药物免疫原性常通过ADA评估,ADA可能会改变药物的药代动力学和药效学特性[27]。在更严重的情况下,ADA可以中和药物的治疗效果或发生严重的不良事件[28]。因此,本研究同样进行了两药的免疫原性分析与测定,AK-HER2与对照组ADA和NAB阳性率差异无统计学意义,证明AK-HER2与原研曲妥珠单抗的免疫原性相似。
随着分子生物学和基因组学的快速发展,乳腺癌新药治疗策略和方法不断涌现。尽管新的药物不断被研发和使用,但是由于国家与地区间发展不均衡性,加上每位患者经济条件不同,患者所能承受的经济负担的差异比较大[29],其标化死亡率差异明显[30]。与城市患者相比,农村患者经济条件较差,导致农村乳腺癌患者延迟就诊率较高,治疗依从性较低,这导致农村乳腺癌患者预后更差[8,30]。基于此,新研发的生物类似药价格低,可减轻患者的经济负担,目前已有曲妥珠单抗生物类似药被批准进入临床治疗[31]。
综上所述,AK-HER2组和曲妥珠单抗组的ORR9、ORR16、DCR、CBR、PFS和生存率差异无统计学意义。在药代动力学、免疫原性、药物不良反应、心脏毒性等其他方面,两组差异无统计学意义。本研究结果可为中国生物类似药的研发提供参考。
致谢:
感谢所有参与临床试验的研究者、管理组、监管者,感谢厦门大学附属第一医院叶峰医师、安徽医科大学第一附属医院顾康生医师、湘潭市中心医院封元清医师、第四军医大学唐都医院张贺龙医师、安徽医科大学第二附属医院陈振东医师、中国医科大学附属盛京医院吴荣医师、新疆医科大学附属肿瘤医院李迅医师与刘炜医师、江西省肿瘤医院吴毓东医师、烟台毓璜顶医院孙萍医师、北京大学人民医院王殊医师、四川大学华西医院邹立群医师、浙江大学医学院附属第一医院沈朋医师、郑州市第一人民医院邬德东医师、广州医科大学附属第一医院张还珠医师、云南省肿瘤医院刘德权医师、南昌市第三医院王红医师、济南市中心医院孙玉萍医师与孙美丽医师、四川省人民医院刘锦平医师、徐州市中心医院刘勇医师、新疆维吾尔自治区中医医院耿中利医师和柳州市人民医院朱州医师(排名按照患者入组例数)。感谢安徽安科生物工程(集团)股份有限公司为本研究提供研究药物与研究经费。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
罗扬:实施研究,采集数据,撰写与修改文章;孙涛、邵志敏、崔久嵬、潘跃银、张清媛、程颖、李惠平、杨燕、叶长生、于国华、王京芬、刘运江、刘新兰、周宇红、柏玉举、谷元廷、王晓稼:参与患者入组实施研究,采集数据;徐兵河:引导研究方向与课题设计;宋礼华提供研究药物与研究经费。
[参考文献]
[1] LEI S Y, ZHENG R S, ZHANG S W, et al. Global patterns of breast cancer incidence and mortality: a population based cancer registry data analysis from 2000 to 2020[J]. Cancer Commun, 2021, 41(11): 1183-1194.
[2] 刘宗超, 李哲轩, 张 阳, 等. 2020全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2021, 7(2): 1-14.
LIU Z C, LI Z X, ZHANG Y, et al. Interpretation on the report of Global Cancer Statistics 2020[J]. J Multidiscip Cancer Manag Electron Version, 2021, 7(2): 1-14.
[3] FAN L, STRASSER-WEIPPL K, LI J J, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279-e289.
[4] GONDOS A, ARNDT V, HOLLECZEK B, et al. Cancer survival in Germany and the United States at the beginning of the 21st century: an up-to-date comparison by period analysis[J]. Int J Cancer, 2007, 121(2): 395-400.
[5] LEONG S P, SHEN Z Z, LIU T J, et al. Is breast cancer the same disease in Asian and Western countries? [J]. World J Surg, 2010, 34(10): 2308-2324.
[6] LI J, ZHANG B N, FAN J H, et al. A nation-wide multicenter 10-year (1999-2008) retrospective clinical epidemiological study of female breast cancer in China[J]. BMC Cancer, 2011, 11: 364.
[7] CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[8] XUAN Q J, GAO K, SONG Y, et al. Adherence to needed adjuvant therapy could decrease recurrence rates for rural patients with early breast cancer[J]. Clin Breast Cancer, 2016, 16(6): e165-e173.
[9] ANDERSON B O, YIP C H, SMITH R A, et al. Guideline implementation for breast healthcare in low-income and middle-income countries: overview of the Breast Health Global Initiative Global Summit 2007[J]. Cancer, 2008, 113(8 Suppl): 2221-2243.
[10] CHIA K S, REILLY M, TAN C S, et al. Profound changes in breast cancer incidence may reflect changes into a Westernized lifestyle: a comparative population-based study in Singapore and Sweden[J]. Int J Cancer, 2005, 113(2): 302-306.
[11] LI J J, SHAO Z M, XU B H, et al. Use of trastuzumab as an adjuvant/neoadjuvant therapy in patients with HER2 positive breast cancer in China: the Nvwa study[J]. Medicine, 2018, 97(21): e10350.
[12] SAN MIGUEL Y, GOMEZ S L, MURPHY J D, et al. Agerelated differences in breast cancer mortality according to race/ethnicity, insurance, and socioeconomic status[J]. BMC Cancer, 2020, 20(1): 228.
[13] DREYER M S, NATTINGER A B, MCGINLEY E L, et al. Socioeconomic status and breast cancer treatment[J]. Breast Cancer Res Treat, 2018, 167(1): 1-8.
[14] CARRERA P M, KANTARJIAN H M, BLINDER V S. The financial burden and distress of patients with cancer: understanding and stepping-up action on the financial toxicity of cancer treatment[J]. CA Cancer J Clin, 2018, 68(2): 153-165.
[15] KIM H, ALTEN R, AVEDANO L, et al. Correction to: the future of biosimilars: maximizing benefits across immune-mediated inflammatory diseases[J]. Drugs, 2020, 80(10): 1039-1040.
[16] WANG J X, NIU S P, DONG W L, et al. A randomized phase I clinical trial comparing the pharmacokinetic, safety, and immunogenicity of potential biosimilar recombinant human HER2 monoclonal antibody for injection and trastuzumab in healthy Chinese adults[J]. Expert Opin Investig Drugs, 2020, 29(7): 755-762.
[17] EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[18] BASELGA J, CORTS J, KIM S B, et al. Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J]. N Engl J Med, 2012, 366(2): 109-119.
[19] Trial validates biosimilar for trastuzumab[J]. Cancer Discov, 2016, 6(7): 686-687.
[20] RUGO H S, BARVE A, WALLER C F, et al. Effect of a proposed trastuzumab biosimilar compared with trastuzumab on overall response rate in patients with ERBB2 (HER2)-positive metastatic breast cancer: a randomized clinical trial[J]. JAMA, 2017, 317(1): 37-47.
[21] MARTY M, COGNETTI F, MARANINCHI D, et al. Randomized phase Ⅱ trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: the M77001 study group[J]. J Clin Oncol, 2005, 23(19): 4265-4274.
[22] ZHU X, DING Y, YU Y, et al. A Phase 1 randomized study compare the pharmacokinetics, safety and immunogenicity of HLX02 to reference CN- and EU-sourced trastuzumab in healthy subjects[J]. Cancer Chemother Pharmacol, 2021, 87(3): 349-359.
[23] WISMAN L A, DE COCK E P, REIJERS J A, et al. A phase I dose-escalation and bioequivalence study of a trastuzumab biosimilar in healthy male volunteers[J]. Clin Drug Investig, 2014, 34(12): 887-894.
[24] WYNNE C, HARVEY V, SCHWABE C, et al. Comparison of subcutaneous and intravenous administration of trastuzumab: a phase Ⅰ/Ⅰb trial in healthy male volunteers and patients with HER2-positive breast cancer[J]. J Clin Pharmacol, 2013. Epub ahead of print.
[25] BASELGA J. Phase Ⅰ and Ⅱ clinical trials of trastuzumab[J]. Ann Oncol, 2001, 12(Suppl 1): S49-S55.
[26] VAISMAN-MENTESH A, GUTIERREZ-GONZALEZ M, DEKOSKY B J, et al. The molecular mechanisms that underlie the immune biology of anti-drug antibody formation following treatment with monoclonal antibodies[J]. Front Immunol, 2020, 11: 1951.
[27] HANSEL T T, KROPSHOFER H, SINGER T, et al. The safety and side effects of monoclonal antibodies[J]. Nat Rev Drug Discov, 2010, 9(4): 325-338.
[28] GINSBURG O, BRAY F, COLEMAN M P, et al. The global burden of women’s cancers: a grand challenge in global health[J]. Lancet, 2017, 389(10071): 847-860.
[29] 刘威, 王黎君, 齐金蕾, 等. 1990-2017年中国女性乳腺癌疾病负担分析[J]. 中华流行病学杂志, 2021, 42(7): 1225-1230.
LIU W, WANG L, QI J, et al. Disease burden of breast cancer in women in China, 1990-2017[J]. Chin J Epidemiol, 2021, 42(7): 1225-1230.
[30] HUO Q, CAI C, YANG Q F. Rural-urban disparities contributed to distinct outcomes of early stage breast cancer[J]. Oncol Res Treat, 2014, 37(10): 596-597.
[31] XU B H, ZHANG Q Y, SUN T, et al. Efficacy, safety, and immunogenicity of HLX02 compared with reference trastuzumab in patients with recurrent or metastatic HER2-positive breast cancer: a randomized phase Ⅲ equivalence trial[J]. BioDrugs, 2021, 35(3): 337-350.
作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#乳腺癌# #曲妥珠单抗# #AK-HER2# #药代动力学#
28