Nat Commun:Smad4缺失抑制PAK3表达并促进侵袭性肺癌的转移
2021-08-16 xiaozeng MedSci原创
肺癌是全球癌症相关死亡的主要原因,其大致可分为小细胞肺癌和非小细胞肺癌(NSCLC)。
肺癌是全球癌症相关死亡的主要原因,其大致可分为小细胞肺癌和非小细胞肺癌(NSCLC)。超过85%的肺癌被归类为NSCLC。既往研究显示,在30%到50%的NSCLC样本中发现了Kras基因的激活突变,其是肺癌中最常见的基因改变之一。
Smad4作为一种肿瘤抑制因子,是TGF-β信号转导通路的中枢细胞内介质。研究显示,Smad4的失活与不同类型的癌症相关。而在肺癌中也发现了SMAD4的突变,但Smad4的功能丧失(LOF)加速肺癌转移的潜在机制尚不清楚。
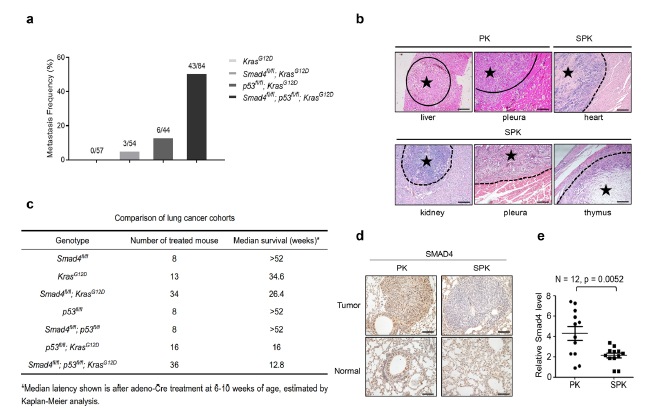
在该研究中,研究人员构建了具有条件性Kras G12D突变、p53fl/fl LOF突变以及Smad4fl/fl LOF突变(SPK)的高度侵袭性肺癌小鼠模型,该小鼠表现出比Kras G12D、p53fl/fl(PK)小鼠更高的肿瘤转移发生率。
Smad4缺失会加速肺癌的发生和转移
研究人员发现,PAK3是Smad4的下游效应因子,其能够通过PAK3-JNK-Jun信号通路介导转移性信号的转导。Smad4 LOF在SPK小鼠中对PAK3表达水平的上调是通过减弱microRNA miR-495和miR-543的Smad4依赖性转录来实现的。
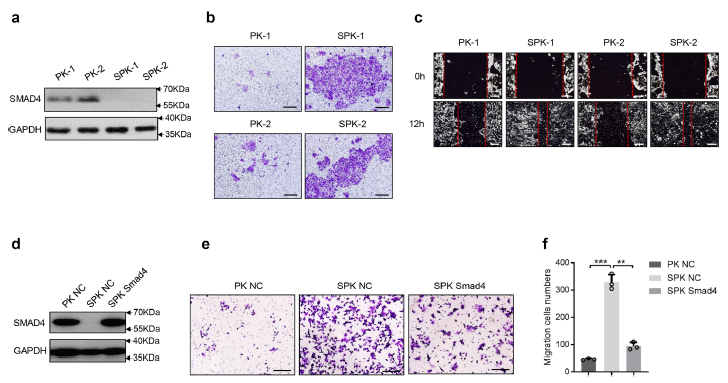
Smad4缺乏促进肺癌细胞的迁移和侵袭
上述这些miRNA能够直接与PAK3 3'UTR区域结合并阻断PAK3的产生,最终调节肺癌的转移。进一步的研究也在人肺癌中观察到Smad4和PAK3通路成分之间的负相关性。
总而言之,该研究结果强调了Smad4-PAK3调节是转移性肺癌的一个潜在的治疗靶点。
原始出处:
Tan, X., Tong, L., Li, L. et al. Loss of Smad4 promotes aggressive lung cancer metastasis by de-repression of PAK3 via miRNA regulation. Nat Commun 12, 4853 (11 August 2021).
作者:xiaozeng
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#COMMUN#
61
#Nat#
58
#Smad#
62
学习
77
#SMA#
52