他尼珠单抗还能用吗?FDA提出安全顾虑
2021-03-23 Oranhgy MedSci原创
近日,美国食品和药物管理局(FDA)最新公布的一份简报文件中,辉瑞和礼来的抗NGF骨关节炎药物他尼珠单抗(tanezumab)的关键安全性问题。
近日,美国食品和药物管理局(FDA)最新公布的一份简报文件中,尽管临床试验已经证明该药可以帮助骨关节炎患者,但还是列举了辉瑞和礼来的抗NGF骨关节炎药物他尼珠单抗(tanezumab)的关键安全性问题。

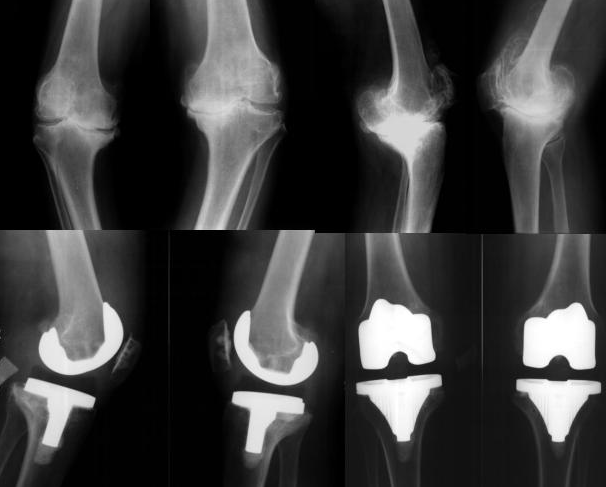
在以往的研究中发现,与该药相关的主要安全性问题是快速进展的骨关节炎(RPOA),作为制造商的辉瑞和礼来也注意到该问题,并且正在积极寻求根据FDA的风险评估和缓解策略(REMS)来评估和监测该药物及相关的安全性问题。然而FDA在审查文件中表示,"拟议的REMS不足以减轻RPOA的风险,也不能确保他尼珠单抗的益处大于RPOA的风险。"
FDA补充称,尽管两家公司在研究中提出了临床风险缓解策略,但RPOA的风险仍然令人担忧,因为相当一部分发生该不良事件的患者需要进行全关节置换。特别是,15%的患者在RPOA1后进展为全关节置换(TJR),而60%的患者在RPOA2后进展为TJR。
同时,FDA还进一步指出,RPOA发生后停药 "似乎不能有效防止关节的进一步损伤"。
此外,他尼珠单抗可能会引起外周感觉异常,多表现为轻度的、有时是自限性的单神经病变。
根据简报文件,FDA尚未对REMS申请做出最终决定。文件中写道,该机构审查小组将在即将举行的咨询委员会会议上进一步研究各公司的其他见解。
他尼珠单抗的开发时间已超过15年;2004年4月首次提交研究性新药申请。该药物最初被提出作为一种止痛药,用于治疗几种不同的疼痛症状,以支持批准一个广泛的疼痛适应症。辉瑞共进行了41项临床研究、38项干预性试验和3项观察性研究,参与人数均超过近18000人。

早在2019年4月,辉瑞公司和礼来公司就公布了一项3021人的III期试验的顶线结果,该试验的特点是在中度至重度膝关节或髋关节骨性关节炎中使用两种剂量的他尼珠单抗。研究结果喜忧参半,5mg剂量组满足了三个辅助疗效终点中的两个,但在骨关节炎的总体评估上未达标。此外,2.5 mg组在其疼痛物理功能或总体评估上没有统计学意义上的改善。
与只接受非甾体抗炎药的患者组相比,他尼珠单抗组也出现了更多的安全事件。研究中共报告了10例死亡病例,其中9例为数字队列。研究者指出,这些死亡病例都不被认为与研究治疗有关。
2020年,美国FDA接受其皮下注射止痛药他尼珠单抗的生物制品许可申请(BLA),治疗因中重度骨关节炎(OA)而引起慢性疼痛的患者。
OA由骨骼两端具有保护功能的软骨磨损导致,是一种进展型的关节疾病。他尼珠单抗是一款人源化神经生长因子(NGF)单克隆抗体,也是首款得到FDA快速通道资格的NGF抑制剂。tanezumab的研究目前主要针对OA疼痛、重度慢性腰疼(CLBP)以及由于癌症骨转移引起的疼痛这三类疼痛的治疗。
2020年10月晚些时候,辉瑞和礼来都宣布,该药在多项III期骨关节炎试验中使疼痛缓解和身体功能得到一致改善。然而,在这些试验中,增加他尼珠单抗的剂量导致不良事件的发生率更高,包括外周感觉异常。但是研究人员称,可能降低交感功能的不良事件在各治疗组之间是平衡的,没有证据表明他尼珠单抗会导致交感神经系统功能障碍。
而如今,FDA也将重新审视该药的临床收益以及风险之间的关系。
作者:Oranhgy
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#他尼珠单抗#
54