诺华CAR-T疗法Kymriah:达到滤泡性淋巴瘤试验终点
2020-08-05 MedSci原创 MedSci原创
ELARA 2期试验的中期分析报告显示:Kymriah达到了完全缓解率(CRR)的主要终点。
诺华的CAR-T细胞疗法Kymriah(tisagenlecleucel)治疗复发或难治性滤泡性淋巴瘤,ELARA 2期试验的中期分析报告显示:Kymriah达到了完全缓解率(CRR)的主要终点。完全缓解率是滤泡性淋巴瘤患者对治疗应答的评价标准。
Kymriah是美国食品和药物管理局(FDA)于2017年8月批准的第一项CAR-T疗法,目前已获批两种适应症:复发或难治性急性淋巴细胞白血病和复发或难治性成人弥漫性大B细胞淋巴瘤。
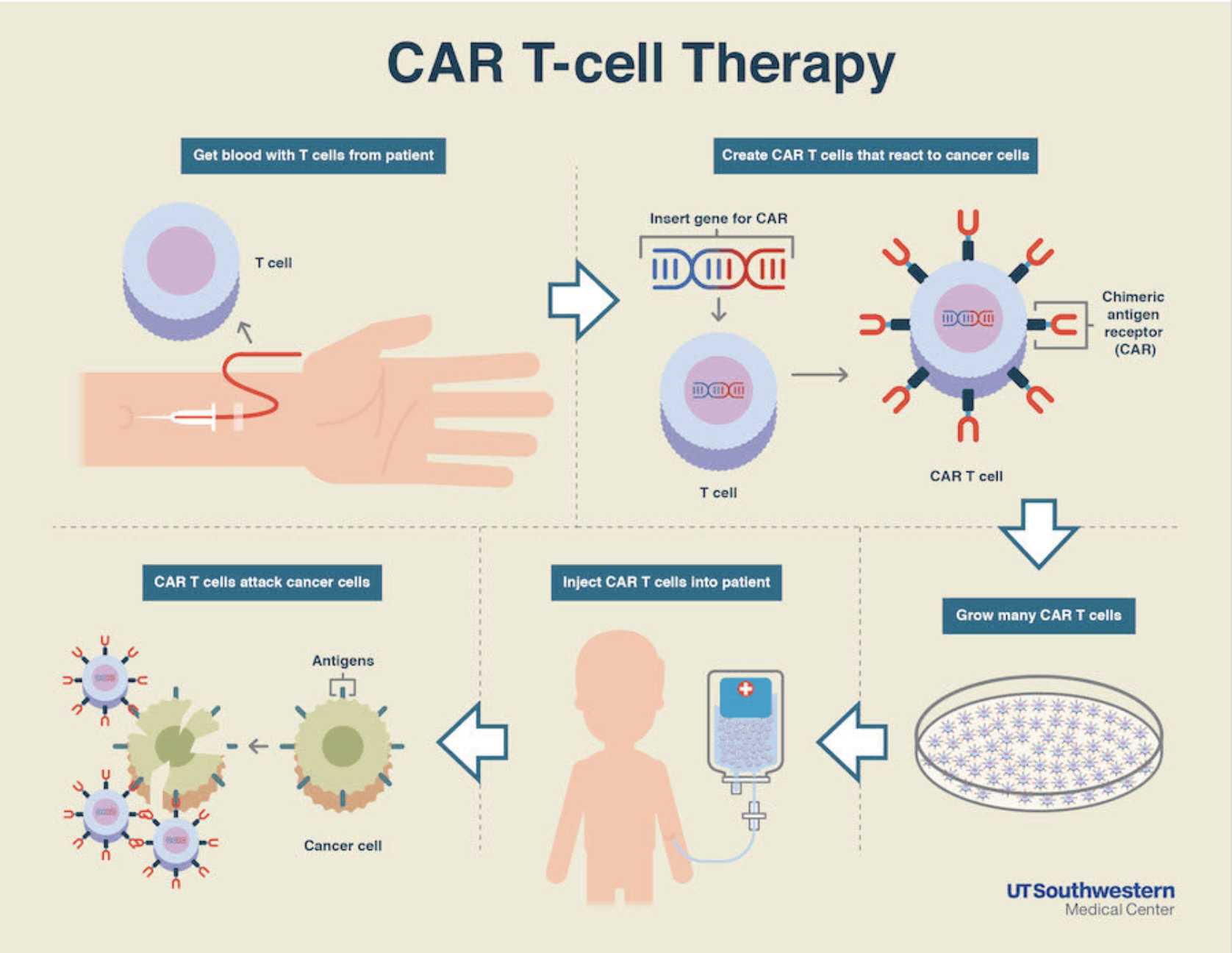
图片来源:http://www.drugood.com/2018/08/25/yescarta-vs-kymriah-which-car-t-product-is-better/
CAR-T细胞疗法是通过分离患者自身的T细胞,在体外进行重编程并扩增后,再回输到患者进行治疗。目前FDA共批准了两款CAR-T产品,分别是诺华的Kymriah和吉利德的Yescarta。两款产品都是靶向B细胞表面的CD19,但是在CAR的设计有所差异。Kymriah的共刺激域是4-1BB,而Yescarta的共刺激域是CD28。
Kymriah由诺华与宾夕法尼亚大学合作开发,根据诺华公司的说法,ELARA试验的结果将包括在监管文件中,预计将在2021年向FDA提交,不久后将在欧洲提交。
原始出处:
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CAR-#
36
#Kymriah#
39
#滤泡性淋巴瘤#
42
#诺华#
38