重磅:FDA批准功能性治愈乙肝药物研究,未来有望上市
2016-02-16 MedSci MedSci原创
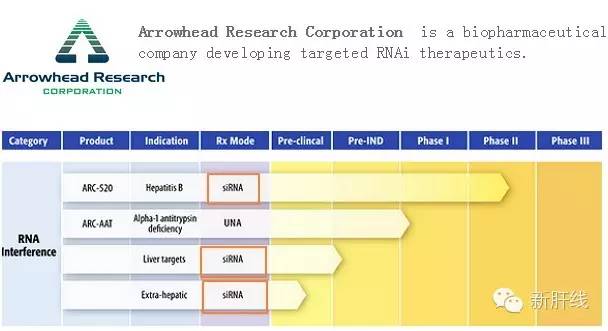
2014年8月,总部位于加利福尼亚州帕萨迪纳市的生物技术公司Arrowhead宣布公司开发的用于治疗乙肝的RNAi药物ARC-520取得良好研究数据。2015年3月,Arrowhead耗资3500万买进了诺华抛弃的RNAi项目,此外在2011年,Arrowhead以同样的方式买进了被罗氏放弃的RNAi项目。 目前,Arrowhead公司有3种RNAi药物处于临床开发阶段,乙肝药物ARC-520是
2014年8月,总部位于加利福尼亚州帕萨迪纳市的生物技术公司Arrowhead宣布公司开发的用于治疗乙肝的RNAi药物ARC-520取得良好研究数据。2015年3月,Arrowhead耗资3500万买进了诺华抛弃的RNAi项目,此外在2011年,Arrowhead以同样的方式买进了被罗氏放弃的RNAi项目。
目前,Arrowhead公司有3种RNAi药物处于临床开发阶段,乙肝药物ARC-520是走的最远的一个项目;此外该公司RNAi的pipeline还包括一种罕见病药物ARC-AAT以及治疗肝脏疾病的一系列临床前资产。
2015年4月13日,美国生物技术公司Arrowhead—乙肝RNAi药物ARC-520传来好消息,美国FDA已批准继续推进ARC-520的一项多剂量IIb期临床研究Heparc-2004。目前,ARC-520正处于II期临床开发,该药每月注射一次,具有功能性治愈乙肝的潜力。
Arrowhead计划在一个月内启动患者招募工作并启动该项多剂量IIb期研究;公司也正在与美国以外的多家监管机构合作,启动额外的IIb期研究。
Heparc-2004是一项多中心、随机、双盲、安慰剂对照、多剂量IIb期研究,计划招募12例正接受恩替卡韦(entecavir)或替诺福韦(tenofovir)维持治疗的慢性免疫活动期HBV感染者。
在研究过程,将按照2:1的比例随机分配患者,即其中8例患者接受静脉注射ARC-520(剂量:1mg/kg体重,每月注射一次,共注射3次),4例患者静脉注射安慰剂,随后对患者随访至少147天。
主要目标是评估患者经3剂ARC-520治疗后,乙肝病毒(HBV)水平的下降幅度;次要目标是评估ARC-520的安全性、耐受性和药代动力学,并调查ARC-520对恩替卡韦和替诺福韦的潜在作用,以及其他探索性安全性和药效学目标。
关于ARC-520:
ARC-520是一种基于RNA干扰(RNAi)用于治疗慢性B型肝炎(乙肝)的药物,具有功能性治愈乙肝的潜力。ARC-520介入信使核糖核酸(mRNA)水平是乙肝病毒逆转录过程的上游,也是当前临床最常使用的核苷和核苷类似物标准治疗药物的作用靶标。
ACR-520采用了Arrowhead公司独有的Dynamic Polyconjugates输送系统,其原理是通过RNA干扰作用来封闭乙肝病毒某些蛋白的表达,导致病毒无法增殖,然后再利用人体免疫系统对剩余病毒进行清除,实现免疫清洁状态(immune clearant state),特征为乙肝表面抗原(HBsAg)血清学转阴以及有或无血清学转换。
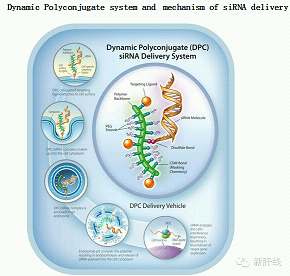
目前,Arrowhead公司已完成了了I期单剂量递增研究,正在开展单剂量IIa研究和多剂量IIb期研究。
MedSci编辑按:
丙肝已经被治愈,但乙肝依然是顽疾!希望新型药物能打开这个禁地!其实,如果中国允许一支药数万元的话,老美这些药厂就有研发动力了!
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#FDA批准#
24
#功能性#
31
#重磅#
31
期待
165
拭目以待
121