K药今日正式登陆中国,新适应症加速获批
2018-08-21 MedSci MedSci原创
国家药监局近期可谓雷厉风行,魄力十足,对一系列重磅新药大开绿灯。 抗艾明星药捷扶康前脚刚刚获批,肺癌新药安圣莎后脚成功入华,而免疫治疗领域最重磅的PD-1抑制剂Keytruda在获批后,终于也要正式登陆中国市场。 帕博利珠单抗注射液 Keytruda 民间简称“K药” 2018年7月20日,默沙东的重磅创新药物帕博利珠单抗注射液(英文商品名:K
国家药监局近期可谓雷厉风行,魄力十足,对一系列重磅新药大开绿灯。这是继O药以后,第二个在中国上市的肿瘤免疫治疗药物(定了!欧狄沃定价9260RMB(100mg),28日将在中国多城市开售)
有关O药与K药的大对比,详细见:O药 vs. K药论剑华山,11种癌症临床研究数据对比

帕博利珠单抗注射液
Keytruda
民间简称“K药”
2018年7月20日,默沙东的重磅创新药物帕博利珠单抗注射液(英文商品名:Keytruda;民间简称K药)的上市申请正式获得国家药品监督管理局的批准,用于黑色素瘤治疗。
这意味着这款风靡全球,创下中国进口抗肿瘤生物制剂最快审批记录的神药在中国获批上市,患者在家门口就能用上最先进的药物。
受益于我国药品审评审批制度改革等一系列利好政策,中国患者和国际同步用上创新药已不是梦。
更加令人振奋的是,国家药监局药品审评中心日前发布了《关于征求境外已上市临床急需新药名单意见的通知》:

通知
为加快境外已上市临床急需新药进入我国,组织专家遴选了48种境外已上市临床急需新药名单,其中包括12款肿瘤药,均为相关适应症暂未在我国获批上市,主要用于治疗罕见病、防治严重危及生命或严重影响生活质量疾病且尚无有效治疗手段或具有明显临床优势的新药。
纳入名单的药品,尚未进行申报或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,加速审评审批速度。
而K药是此次入选这48个急需药品清单的唯一一个肿瘤免疫治疗PD-1药物。
为什么是K药呢?
首先,有巨大的需求存在。
中国在晚期肺癌、肝癌、胃肠癌等癌种患者人数众多,治疗手段有限,严重危及患者的生命,影响其生活质量,一系列领域存在巨大的未被满足的治疗需求。国家希望通过这种快速审评机制,能让更多的患者受益。
第二,K药是美国FDA批准上市的首款PD-1抑制剂。
早在2014年9月4日,FDA就批准K药用于治疗晚期黑色素瘤。
第三,K药疗效具有广谱性。
从全球范围获批适应症数量来看,它已在80多个国家获批使用,覆盖了9个癌种的12个适应症,包括非小细胞肺癌、MSI-H实体瘤、胃癌、头颈癌、膀胱癌、子宫颈癌、霍奇金淋巴瘤、大B细胞淋巴瘤等多个癌种。
特别值得一提的是,K药于2017年5月革命性地被批准上市用于治疗MSI-H(微卫星不稳定性高)实体瘤,这是FDA批准的首款不依照肿瘤来源,而是依照生物标志物进行区分的抗肿瘤疗法,成为第一个真正意义上的广谱抗癌药。

第四,K药显示出长期生存优势。
众多临床数据显示了K药在恶性黑色素瘤,非小细胞肺癌领域治疗的长期生存优势。
我们先来看Keynote001研究中,接受K药治疗的晚期黑色素瘤患者5年随访数据:

图1 Keynote001研究中晚期黑色素瘤患者的
5年总生存期(OS)数据
接受K药治疗的晚期黑色素瘤患者中,34%的人群生存时间超过5年,在初治患者中更有高达41%的人群生存时间超过5年(图1),意味着接近四成的患者可以活过5年。
单单K药,在全世界就有超过700个临床试验正在进行,多数都是联合其他药物一起治疗。有些结果已经让人眼前一亮,比如,在今年公布的非小细胞肺癌试验中(代号KEYNOTE-189),K药联合化疗的总缓解率是单用化疗的两倍以上,而且显著提高了患者总生存率和无进展生存率,让死亡风险降低了50%左右。
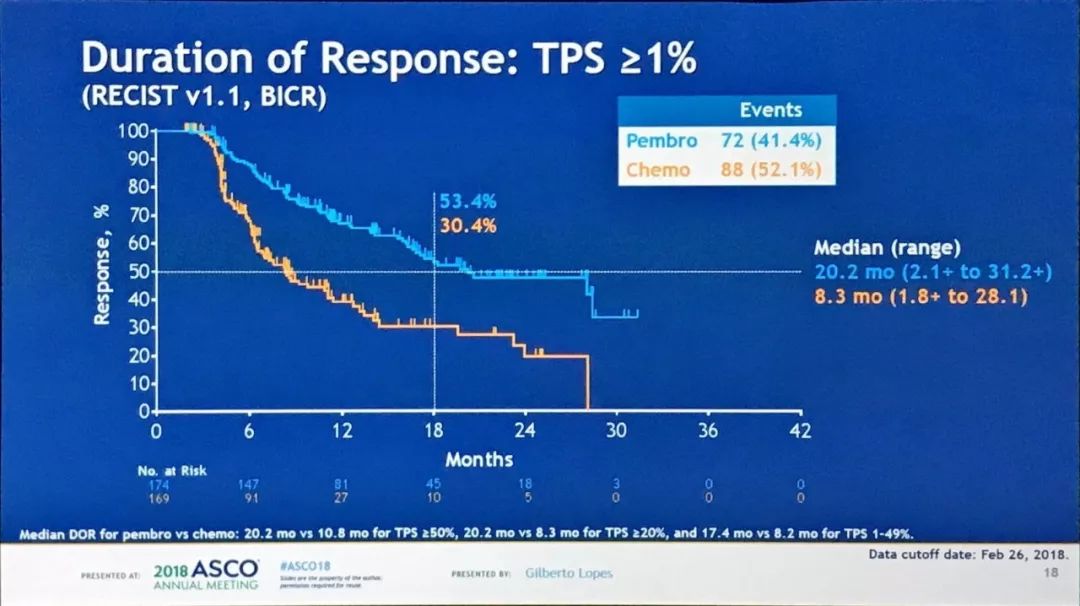
再来看Keynote001研究中,接受K药治疗的晚期肺癌患者4年随访数据:
经治患者中,16.4%的人群生存时间超过4年,初治患者中高达27.2%的人群生存时间超过4年;对于PD-L1表达≥50%的初治患者,4年OS率更是高达48.1%。再次彰显了K药的长期生存优势。
北京大学肿瘤医院副院长沈琳教授对此评论到:
近几年,以帕博利珠单抗为代表的PD-1免疫检查点抑制剂为晚期肿瘤治疗带来了革命性的变化,尤其在非小细胞肺癌、恶性黑色素瘤、MSI-H(包括结直肠癌等15个瘤种)的晚期癌症治疗上为患者带来了巨大的生存获益。
在美国,帕博利珠单抗获批多达12个适应证,治疗十种不同的晚期肿瘤。
然而,在国内,帕博利珠单抗刚获批用于治疗不可手术或转移性黑色素瘤,也是目前唯一一个获批的适应症。
但是我国在肺癌、肝癌、胃肠癌治疗领域存在巨大的未被满足的治疗需求,这可能就是为什么此次帕博利珠单抗作为唯一的一个PD-1单抗,被纳入临床急需新药快速审批名单的一个重要原因。
我们希望通过国家这种快速审批机制,能有更多创新药物快速惠及中国肿瘤病人。
继今年7月获批后,K药已于今天运抵中国,正式登陆中国市场。中国患者再也不用奔波于香港和海外,可以更便捷地用上正规途径的药了。
不过,也可以预见,O药与K药会有一番大战。目前O药稍快一步,在国内已有定价,年底前即可形成销售。K药可能要略晚一些。
作者:MedSci
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#适应症#
38
#新适应症#
41
#K药#
52
谢谢分享,学习了
56
嗯嗯,学习学习。
65