便宜又好用的肿瘤生物仿制药,你了解有多少?
2019-02-26 维生素C 医学界肿瘤频道
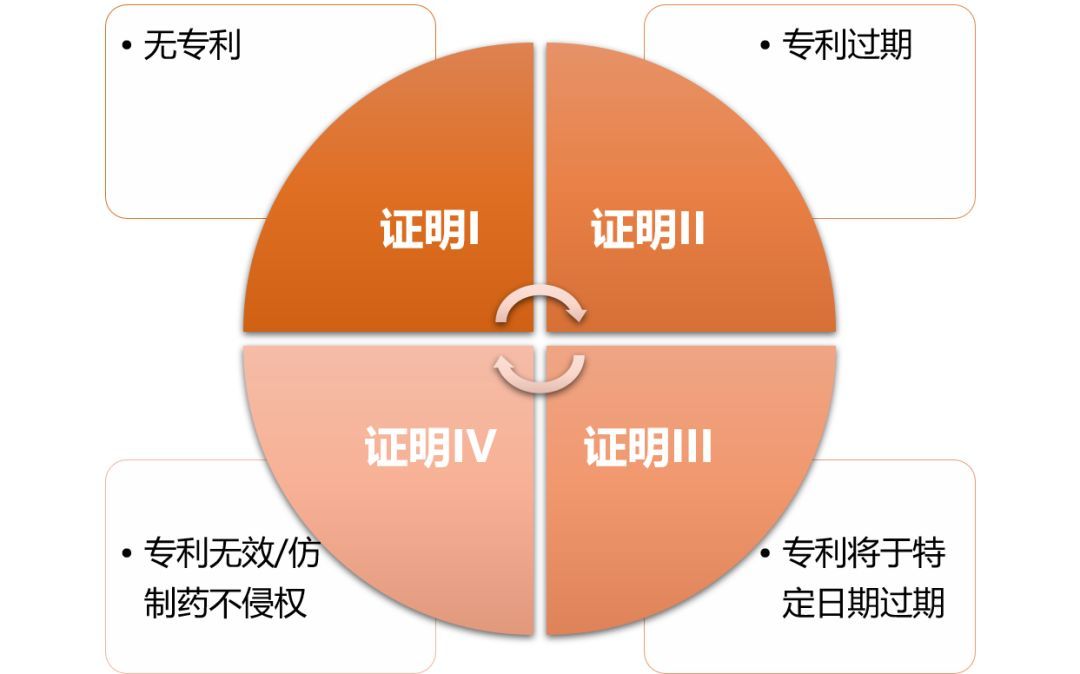
提到生物仿制药,大家可能嗤之以鼻。在我国,一提“仿制”两个字,人们往往联想到山寨、盗版、非法等字眼。而国际上的生物仿制药(biosimilar)却是指对原研专利生物药在其专利失去的市场独占权法律保护后,进行的合法仿制。从成分上来讲,仿制药与品牌药相差无几,是货真价实的真药。我们先来了解一下概念:原研药是指原创性的新药,在全球最先提出申请,并获得专利保护的药品,一般有20年的保护期,在保护期内,
作者:维生素C
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#仿制药#
78
#生物仿制药#
60