FDA批准艾替班特(Firazyr)治疗遗传性血管性水肿(HAE)急性发作
2011-10-09 MedSci原创 MedSci原创
(资料图) 8月25日,美国食品和药物管理局(FDA)批准Firazyr (通用名:艾替班特)注射剂治疗年龄≥18岁成人的一种罕见疾病——遗传性血管性水肿(HAE)的急性发作。 HAE是由于一种称为C1抑制剂的蛋白水平低或功能障碍引起的,这种蛋白涉及免疫系统的调节和凝血通路的功能。病人通常有该病的家族史。美国的HAE患者不到3万人。 HAE病人可出现手、足、四肢、面部、
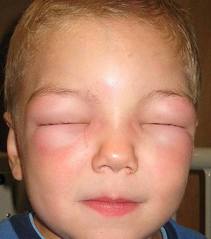
(资料图)
8月25日,美国食品和药物管理局(FDA)批准Firazyr (通用名:艾替班特)注射剂治疗年龄≥18岁成人的一种罕见疾病——遗传性血管性水肿(HAE)的急性发作。
HAE是由于一种称为C1抑制剂的蛋白水平低或功能障碍引起的,这种蛋白涉及免疫系统的调节和凝血通路的功能。病人通常有该病的家族史。美国的HAE患者不到3万人。
HAE病人可出现手、足、四肢、面部、肠道、喉头或气管的快速水肿,这可能导致毁容、失能或死亡。消化道水肿可引起腹痛、恶心和呕吐,而呼吸道水肿则使病人有窒息的危险。
美国FDA药物评价与研究中心药物评价Ⅱ办公室主任Curtis Rosebraugh说:“Firazyr给治疗HAE急性发作提供了一个新选择,因其能通过在腹部注射自我给药,病人可在意识到HAE急性发作时自我治疗。”
Firazyr的安全性和有效性在3项对照临床试验(开放标签扩展期)中得到证实,试验中225例病人接受了1076剂30 mg的Firazyr。接受Firazyr治疗的病人至症状缓解的中位时间为2小时,而用安慰剂者接近20小时。
在美国Firazyr是获准用于治疗HAE发作的第三个药物。2009年10月,FDA批准Berinert治疗HAE的面部和腹部发作,2009年12月,Kalbitor获准用于治疗≥16岁病人的HAE急性发作。
FDA批准了Firazyr的病人用药指导,包括注射说明。Firazyr最常见的副作用是注射部位反应、发热、肝酶升高、眩晕和皮疹。
原文链接:FDA approves Firazyr to treat acute attacks of hereditary angioedema
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言




#艾替班特#
65
#FDA批准#
70
#AZ#
88
#HAE#
76
#血管性#
79