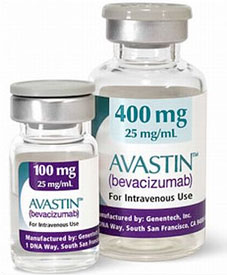
辉瑞的Avastin生物仿制药——ZIRABEV在欧洲获批治疗多个转移性肿瘤
2019-02-20 不详 MedSci原创
欧洲委员会(EC)近日批准辉瑞的ZIRABEV用于治疗转移性结肠或直肠癌、转移性乳腺癌、不可切除的晚期转移性或复发性非小细胞肺癌(NSCLC)、晚期或转移性肾细胞癌以及持续复发的转移性宫颈癌。
作者:不详
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#VAST#
97
#AST#
70
#仿制药#
63
#欧洲#
63
#转移性#
55