3月22日,中国国家药品监督管理局药品审评中心(CDE)最新公示,信达生物(香港联交所股票代码:01801)PI3Kδ口服抑制剂parsaclisib已被纳入拟突破性治疗品种,拟定适应症为复发性或难治性滤泡性淋巴瘤。
滤泡性淋巴瘤是血液系统中形成的一种恶性肿瘤,占全世界非霍奇金淋巴瘤(Non-Hodgkin lymphoma, NHL)的22%,占我国NHL患者的8.1%-23.5%。该疾病的典型表现为多部位淋巴组织侵犯或者肝脾肿大,严重时会造成全身各个组织和器官出现系统性问题,从而威胁到患者生命。

2018年12月,信达生物与Incyte就parsaclisib等三个处于临床试验阶段候选药物达成战略合作。其中,parsaclisib是一种强效、高选择性、新一代磷脂酰肌醇3-激酶δ(PI3Kδ)口服抑制剂,。PI3Kδ信号通路是恶性B细胞和肿瘤细胞生长、存活和增殖的重要靶点,抑制该信号通路具有治疗血液肿瘤和实体瘤以及各种因B细胞介导和抗体驱动疾病的潜力。
2020年12月,信达生物的II期临床研究对符合条件的患者在八周内每天一次接受20 mg的Parsaclisib,随后接受每周两次(每周用药剂量组[WG])20 mg或每天一次2.5 mg(每日用药剂量组[DG])的治疗方案。最终,选择了每日一次剂量作为首选方案,允许最初入组WG的患者转换为DG方案。这项临床数据突显了Parsaclisib有潜力成为复发或难治性B细胞非霍奇金淋巴瘤患者的治疗选择。
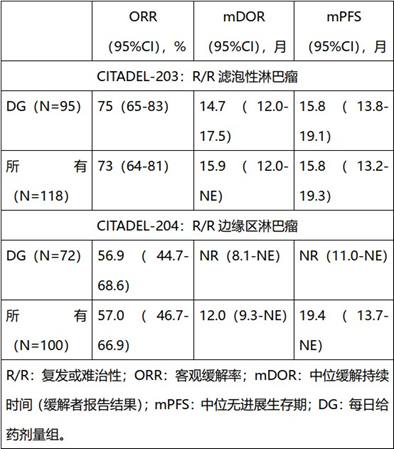
数据源自信达生物官网
据悉,全球首款每日1次口服PI3K/CK1抑制剂是TG公司的umbralisib(商品名UKONIQ),且已于2月5日获得美国食品药品监督管理局(FDA)批准上市。期待Parsaclisib也能早获捷报,为淋巴瘤患者带来新的希望。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#抑制剂#
32
#PI3Kδ#
46
非常厉害👍
80
#PI3K#
36
#信达生物#
43