免疫组化和PCR不是唯一解!NGS液体活检助力林奇综合征诊断并指导后续治疗
2024-08-04 苏州绘真医学 苏州绘真医学
本文介绍了一名 26 岁病例,该患者患有林奇综合征和BRAF突变的转移性结肠癌。传统检测和NGS的MSI结果不一致,给治疗决策带来了挑战。
微卫星不稳定性(MSI)是一种可用于检测和治疗林奇综合征的标志物。尽管免疫组织化学(IHC)和聚合酶链式反应(PCR)等传统技术是MSI检测的标准,但下一代测序(NGS)的出现提供了新的可能性,尤其是循环DNA。本文介绍了一名 26 岁病例,该患者患有林奇综合征和BRAF突变的转移性结肠癌。传统检测和NGS的MSI结果不一致,给治疗决策带来了挑战。NGS检测提示MSI较高,推动患者参与免疫治疗试验,并取得了显著的临床缓解。该案例强调了全面的分子检测和跨学科合作的重要性,尤其是在MSI结果不明确的情况下。
背 景
微卫星不稳定性(MSI)是DNA错配修复缺陷(dMMR)的特征,其中突变的积累发生在整个基因组中,特别集中在微卫星的重复区域中。在实体瘤中,通常会对其进行评估,以初步确认林奇综合征、治疗方向和预后。大多数MSI-H肿瘤为偶发性,常与MLH1启动子高甲基化或BRAF V600E突变有关(特别是结直肠癌[CRC],而其它肿瘤则由遗传性癌症易感综合征引起,例如林奇综合征,源于四种主要错配修复(MMR)基因之一的单等位基因胚系突变:MLH1、MSH2、MSH6、PMS2或EPCAM基因]。MSI-H CRC的肿瘤表型以右侧结肠、低分化黏液腺癌、发病早和免疫检查点抑制剂的缓解率高为特征。目前,dMMR检测的金标准是使用肿瘤组织样本进行免疫组织化学(IHC)和聚合酶链式反应(PCR)。然而,下一代测序(NGS)技术的演变和发展为MSI-H检测提供了新的方法,特别是使用cfDNA。后者引起了广泛关注,因为它是一种微创且易于重复的工具,克服了空间和时间异质性的问题,并允许通过迭代采样对疾病进行纵向监测。因此,人们尝试探究在MSI-H检测中使用传统检测和NGS工具之间的一致性,并且取得了不错的结果。然而,仍存在不一致的情况,因此对制定治疗决策产生挑战。本文提供了一个病例报告作为该问题的一个实际案例。
病 例
患者男,26 岁,无个人或家族癌症病史,在发烧和腹痛 1 周后住院。CT扫描显示右结肠原发性肿块,伴有局部炎症和盆腔积液,无远端转移。在这种情况下,患者接受了紧急手术。病理标本显示R0切除术,右结肠 7 cm浸润性黏液腺癌,47 个淋巴结中有 2 个阳性(T3N1,IIIA期)。对原发肿瘤进行分子检测发现KRAS野生型、BRAF V600E突变,IHC评估MLH1–MSH2–MSH6–PMS2正常表达。由于肿瘤细胞不足(<20%),MSI检测的PCR检测结果无法判读。根据指南建议,患者在 2018 年 1 月至 7 月期间接受了 12 个周期的辅助化疗,化疗方案为静脉(IV)FOLFOX方案[奥沙利铂,85 mg/m2,IV;5-氟尿嘧啶(5-FU),2,400 mg/m2,IV;5-FU,400 mg/m2;亚叶酸钙(LV),400 mg/m2]。由于患者较为年轻,因此考虑进行遗传咨询,并进行了NGS检测,包括基因MLH1、MSH2、MSH6、PMS2、EPCAM、APC、MUTYH POLD1和POLE,未检测到任何有害突变(表1)。发现MSH2基因 13 号外显子存在 3 类意义不明杂合变异c.2012A>C/p.Asn671Thr。由于患者年龄较小,专家组建议作为Lynch样病例进行上下消化道内镜监测(每 2 年一次)。
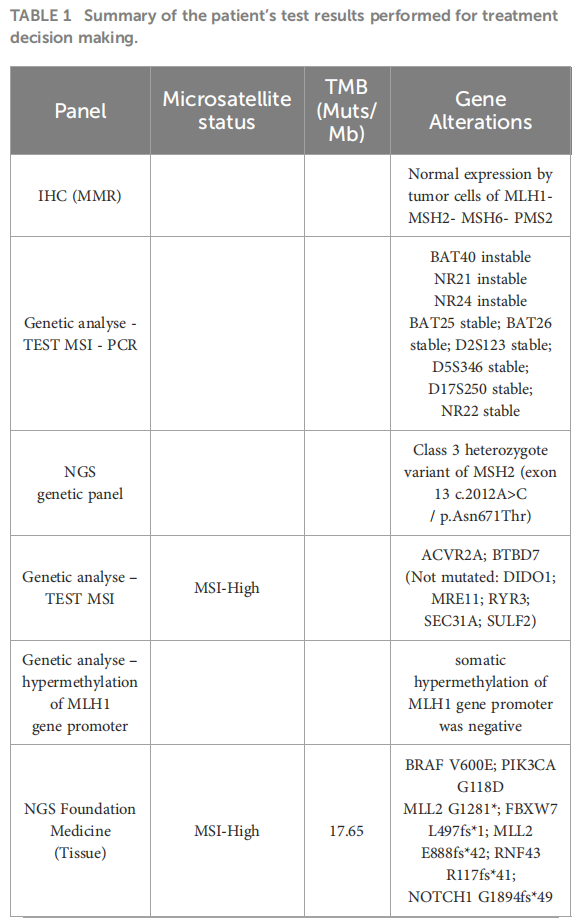
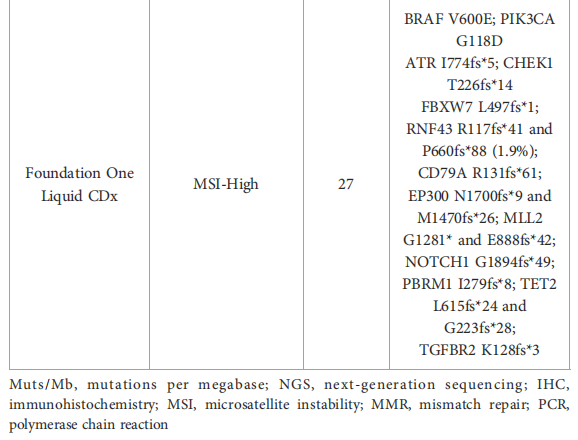
▲表1 检测结果汇总
2018 年 12 月患者出现可切除的肝脏复发,行左肝切除术。由于复发为肝内复发且发生在辅助化疗结束 6 个月后,多学科团队(MDT)决定进行系统性辅助治疗,即静脉FOLFIRI方案(伊立替康,180 mg/m2;5-FU,2400 mg/m2静脉注射 46 小时;5-FU,400 mg/m2;LV,400 mg/m2)联合肝动脉内注射奥沙利铂。患者于 2019 年 2 月至 5 月接受了 3 个月的化疗,耐受性良好。治疗结束时患者实现无病生存。3 个月后,即 2019 年 9 月,CT扫描显示病情进展,并出现腹膜后淋巴结。由于患者存在BRAF V600E突变,MDT决定采用达拉非尼、曲美替尼和帕尼单抗进行靶向治疗(当时还没有公布BEACON试验的结果)。患者取得部分缓解,无进展期为 16 个月(2019 年 9 月至 2021 年 2 月之间),但由于与帕尼单抗相关的 2-3 级皮肤毒性,耐受性有限。2021 年 1 月,该疾病在腹膜后、纵隔和左锁骨上淋巴结再次进展。尽管已知存在BRAF V600E突变和pMMR状态,研究人员决定进行新的NGS分析,该分析使用了液体活检和既往标本(来自肝脏手术)。结果显示,存在MSI-H、肿瘤突变负荷 (TMB) 为 17.65 Muts/Mb,以及BRAF V600E突变,而液体活检证实了MSI-H、TMB-H(27 Muts/Mb)和BRAF V600E突变等(表1)。根据MSI-H结果,患者被纳入一项临床篮子试验,接受 34 个月的阿替利珠单抗二线治疗,获得部分缓解(-76%)和完全代谢缓解,且具有良好的治疗耐受性(图1)。患者的诊断和治疗过程如图2所示。
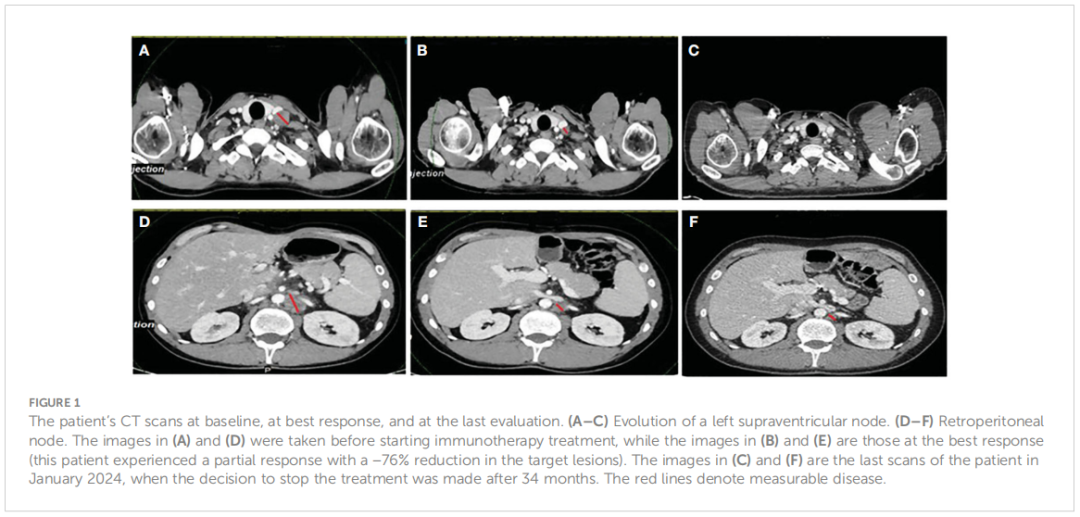
▲图1 患者基线、最佳反应和最后一次评估时的CT影像
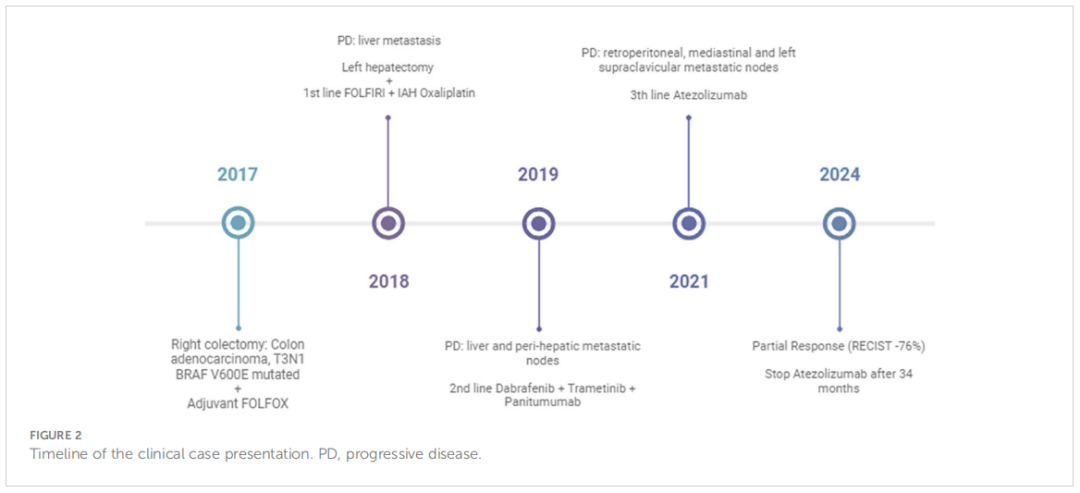
▲图2 治疗时间线
面对这些不一致的结果,研究人员使用来自肝转移的标本进行了MSI分析。分析显示NGS中存在MSI-H表型,但在IHC检测仍为微卫星稳定(MSS)。更换panel后的第二次NGS检测证实了肝标本中存在MSI-H。对本文病例进行MDT讨论后,对MLH1进行了甲基化检测,结果为阴性。该患者被认为患有MSI-H肿瘤。在确认MSI-H结果后,重新进行了胚系分析,并决定对MSH2 13号外显子c.2012A>C/p.Asn671Thr 进行基于甲基化耐受性的功能分析。结果证实了该变异具有致病性,并在遗传MDT中讨论了本文病例。该变异在FrOG数据库被归类为可能致病,研究人员认为患者患有林奇综合征。截至 2024 年 1 月底进行的评估显示完全缓解,并决定停止免疫治疗。患者亲属健康,且未进行任何基因检测。
讨 论
本文介绍了一名 26 岁男性病例,该患者罹患转移性结肠癌,IHC/PCR和NGS的MSI结果之间不一致。在进展期间进行的NGS检测(液体活检和手术组织)得出了MSI-H和TMB-H的结果,这为接受免疫疗法提供了可能性,并取得了令人印象深刻的效果。
在DNA测序出现之前,MSI检测主要依赖于MMR蛋白的IHC和“Bethesda组”五个高度保守位点的PCR评估。然而,鉴于在某些情况下,活检可能没有足够比例的肿瘤细胞,无法正确分析MMR状态,因此相当多的患者可能会存在治疗选择有限。
根据欧洲肿瘤内科学会(ESMO)和美国临床肿瘤学会(ASCO)的建议,当怀疑患有林奇综合征时,应在诊断为CRC时评估患者的MMR状态;对于转移性疾病,也应进行初步分子检查,以确定其对免疫疗法使用的预测价值[证据级别(IA)]。应使用常规技术进行检测,例如MMR-IHC和/或MSI PCR检测。此外,如果使用NGS panel进行MMR检测,则必须具有与上述技术的等效性。
在本病例中,IHC结果表明尽管存在错义变异, MSH2蛋白仍有表达。虽然林奇综合征筛查通常依赖于IHC和/或MSI检测,基因检测仅用于特定病例,但由于患者年龄较小且MSI检测结果不确定,因此有必要进行进一步调查,从而准确识别该综合征。本文患者在初次诊断时,使用常规技术无法判断MSI状态,可能是由于标本细胞数(<20%)或黏液组织学特征导致的。患者接受了标准治疗,但疾病控制期较短。
有多种原因可能导致MSI假阴性结果:①技术问题(对 <5.5 mm的组织碎片进行MSI检测可能产生假阴性MSI结果);②黏液组织学;③林奇综合征(许多患有林奇综合征的个体可能患有MSI-L或MSS表型的肿瘤,导致假阴性结果)。得益于NGS,研究人员能够发现患者患有MSI-H肿瘤,随后他在篮子试验中接受了阿替利珠单抗治疗,这是当时唯一可能获益的方案。
2020 年,Keynote-177 试验公布了帕博利珠单抗治疗MSI-H患者的结果,结果显示无进展生存期有所改善,而且与标准化疗相比,缓解率为 43.8%,随后成为该人群的一线治疗,甚至对携带BRAF V600E突变的患者也有效。得益于II期试验Checkmate 142(2022)的结果,纳武利尤单抗随后获批用于相同情况(联合或不联合伊匹木单抗)。本文患者携带BRAF V600E突变——直到最近才认为该突变是散发性MSI肿瘤的标志。然而,最近在林奇综合征患者中也发现了BRAF V600E突变的存在;因此,如果有临床指征,即使存在BRAF V600E突变也不应排除胚系检测。
总之,应关注MSI状态,尤其是年轻患者的MSI状态,在制定治疗决策中发挥了关键作用。当结果不明确时,需要进行相关咨询,因为准确的诊断可能会改变患者生活。如果无法从肿瘤组织直接确定,cfDNA是一种选择。
参考文献:
Rodriguez JE, Vasseur D, Bani MA, Cabaret O, Cotteret S, Muleris M, Golbarg V, Malka D, Pudlarz T, Caron O, Smolenschi C. Case report: Microsatellite instability determination is not always black and white in Lynch syndrome diagnosis. Front Oncol. 2024 Jun 18;14:1396869. doi: 10.3389/fonc.2024.1396869. PMID: 38957326; PMCID: PMC11217479.

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#林奇综合征# #液体活检# #微卫星不稳定性#
39