J Clin Oncol:“照单全治” ——Nivolumab“广谱”治疗复发或难治型经典霍奇金淋巴瘤患者
2018-04-11 慧语 肿瘤资讯
由于基因改变而导致的PD-L1过表达在经典霍奇金淋巴瘤患者(cHL)中几乎普遍存在。2016年,美国FDA根据Checkmate 205研究中一个队列及Checkmate 039的结果,批准了该药用于经本妥西单抗和自体干细胞移植治疗后复发进展的患者。Nivolumab也成为首个获批治疗血液系统恶性肿瘤的PD-1免疫治疗药物。本次报道Checkmate 205研究中全部3个队列更新后长期随访的有效性
由于基因改变而导致的PD-L1过表达在经典霍奇金淋巴瘤患者(cHL)中几乎普遍存在。2016年,美国FDA根据Checkmate 205研究中一个队列及Checkmate 039的结果,批准了该药用于经本妥西单抗和自体干细胞移植治疗后复发进展的患者。Nivolumab也成为首个获批治疗血液系统恶性肿瘤的PD-1免疫治疗药物。本次报道Checkmate 205研究中全部3个队列更新后长期随访的有效性和安全性结果。Checkmate 205是目前抗PD-1药物治疗血液恶性肿瘤II期或III期临床试验中随访时间最长的一项。
背 景:cHL患者的初步治疗方案通常包括放化疗,若病情复发则会接受自体造血细胞移植(auto-HCT)。如果auto-HCT后,在1年内仍然复发的cHL患者,预后普遍较差,中位生存时间OS仅为2年多。这部分患者如果希望得到持续缓解,传统的手段几乎不能实现。有研究报道了使用本妥昔单抗(Brentuximab Vedotin)治疗auto-HCT失败后的cHL患者有一定疗效,客观缓解率ORR可达75%,中位PFS延长至5.6个月。一部分BV治疗后达到完全缓解的患者持续缓解时间可达5年以上;但对于大多数患者在BV治疗后的1年内仍需进行其它治疗。因此,对于auto-HCT失败后的cHL患者仍有巨大的需求,以期达到持续缓解。
cHL患者普遍有9p24.1的基因突变,导致肿瘤细胞表面PD-1配体PD-L1、PD-L2过表达。而PD-L1、PD-L2能够结合PD-1,从而起到下调T细胞免疫功能的作用,肿瘤细胞躲避免疫。Nivolumab能够阻断PD-1信号通路,重新释放被抑制T细胞的免疫活性,激发免疫系统识别并杀死癌细胞。在一项I期临床试验中,Nivolumab治疗23名严重的复发或难治型cHL患者,其中由20名(87%)达到客观缓解。基于这些理论及实践的结果,开展了CheckMate 205国际多中心II期临床试验(NCT02181738)。2016年报道了队列C中100名复发或难治型cHL患者经Nivolumab治疗后具有较好的疗效。本次主要报道A、B、C三个队列经过更长时间随访的疗效和安全性评价结果。此外,还将报道一些探索性分析结果,包括根据既往治疗顺序或难治状态的亚组分析,肿瘤进展后的治疗结果,以及Nivolumab治疗后进行异体造血细胞移植(allo-HCT)的结果。
方 法:CheckMate 205是一项多中心、单臂临床II期临床试验,受试对象为18周岁以上;经活检确认的auto-HCT失败后的复发或难治型cHL患者。来自欧洲和北美34个中心的入组患者被分配到3个独立的队列中。未接受过BV治疗的患者分配至队列A中;auto-HCT治疗失败后进行BV治疗的患者分配到队列B中;auto-HCT治疗前或/和后使用BV治疗的患者分配到队列C中。排除自身免疫性疾病、第一次使用Nivolumab治疗之前21天内接受过放疗或auto-HCT治疗、每次Nivolumab治疗之前接受过allo-HCT或免疫检查点阻断剂治疗的患者。
主要疗效评价指标为由独立放射学评审委员会(IRC)评估的客观缓解率ORR;次要疗效指标包括IRC评估的持续缓解时间(DOR)、PR和CR的频率及持续时间、研究者评估的ORR和DOR。事先确定的探索性分析指标包括IRC评估的PFS、OS、肿瘤负荷TBP以及安全性评价。疗效评价基于各个队列,安全性评价基于三个队列的患者。
结 果:2014年8月至2015年8月期间,共有276名患者入组,其中243名接受Nivolumab治疗的患者分配到队列A、B、C中(分别有63名、80名和100名患者)。三个队列的基线指标基本相同,中位年龄为34岁,40%的患者继续接受治疗。截止2016年12月数据锁定时,中位随访时间为18个月(IQR:15-22),各队列的中位随访时间分别为19、23和16个月。三个队列患者接受Nivolumab治疗的中位次数为32、32和27。其中队列C中有7名患者达到持续CR后停止治疗,并且截止数据锁定时还未重新接受治疗。
① 疗效评价
所有患者IRC评估的ORR为69%,包括16%的CR以及53%的PR患者。A、B、C三个队列的ORR分别为65%、68%和73%;达到CR的比例分别为29%、13%和12%。95%以上的患者靶向肿瘤负担达到降低。
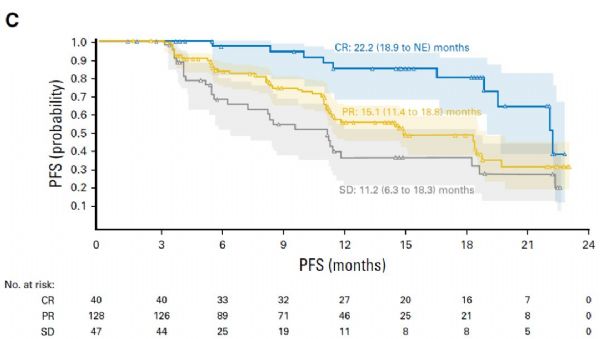
三组队列全部患者的中位第一次客观缓解时间为2.1(IQR 1.9~2.7)个月,中位IRC评估的DOR为16.6(95% CI 13.2~20.3)个月。A、B、C队列DOR分别为20.3、15.9和14.5月。三组队列全部患者的中位PFS为14.7(95% CI 11.3~18.5)个月,A、B、C队列PFS分别为18.3、14.7和11.9月。三组队列全部患者的中位OS尚未观察到,1年OS为92%(95% CI:88%-95%),A、B、C队列1年OS分别为93%(83%-98%)、95%(87%-98%)、90%(82%-94%)。根据患者最佳治疗整体响应(best overall response)分组后,DOR、PFS及OS的比较见图1。
图1 根据治疗响应情况患者的DOR(图B)、PFS(图C)和OS(图D)对比
② 安全性
与药物有关的最常见不良事件为疲劳(23%)、腹泻(15%)和注射相关反应(14%)。最常见的G3和G4级药物相关不良事件包括脂肪酶升高(5%)、中性粒细胞减少症(3%)以及ALT升高(3%)。整个观察期间,共计29名患者死亡,包括18名患者死于肿瘤进展;异体移植死亡5例;多器官衰竭、非典型性肺炎、外周T细胞淋巴瘤、脓毒症、急性低氧性呼吸、肺炎、心脏停搏及未知原因各1例。全部死亡病例均认为与研究药物无关。
17名患者(7%)由于治疗相关不良反应停止治疗;主要是肺炎(2%)与自身免疫性肝炎(1%)。严重药物相关不良事件在12%的患者中发生,主要包括输液相关的不良反应(2%),肺炎(1%),肺炎(1%),胸腔积液(1%),发热(1%)。最常见的免疫介导的不良事件主要包括甲状腺功能减退/甲状腺炎(12%)和皮疹(9%)。
结 论:截止目前的随访阶段Nivolumab显示出较高的缓解率,并对大多数患者都能产生持续的缓解。更为可喜的是,在研究的三个队列中,无论是既往治疗无效的患者,还是先前是否接受过BV治疗的患者,均有持续的获益。并且这种获益还不依赖于是否获得完全缓解CR。探索性研究的结果也进一步证实了对于那些没有发生客观缓解的患者,甚至是一部分发生进展的患者,仍然能够从PD-1阻断剂治疗中持续获益。
综上,Nivolumab能够为auto-HCT后绝大多数复发或难治性cHL患者产生长期的获益。
原始出处:
Armand P,et al.Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol. 2018 Mar 27:JCO2017760793.
作者:慧语
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录







#mAb#
53
#NIV#
51
#Oncol#
54
了解一下.谢谢分享!
83