武田高血压新药「美阿沙坦钾片」在中国获批上市
2021-01-22 医药魔方 医药魔方
1月20日,国家药监局官网显示武田制药1类新药美阿沙坦钾片上市申请已获得NMPA批准。用于治疗原发性高血压。
 1月20日,国家药监局官网显示武田制药1类新药美阿沙坦钾片上市申请已获得NMPA批准。用于治疗原发性高血压。
1月20日,国家药监局官网显示武田制药1类新药美阿沙坦钾片上市申请已获得NMPA批准。用于治疗原发性高血压。
血管紧张素 II由血管紧张素I在血管紧张素酶催化作用下转换而来。血管紧张素II是肾素-血管紧张素系统的主要升压剂,具有促进血管收缩、刺激醛固酮的合成和释放、激动心脏和促进肾脏对钠重吸收等多种生理作用。
美阿沙坦钾是武田自主研发的一款血管紧张素II受体阻滞剂,是一种口服前药,在吸收过程中可被体内酯酶迅速代谢为活性成分阿齐沙坦。后者可通过选择性阻断血管紧张素II与许多组织如血管平滑肌和肾上腺中AT1受体的结合来阻断血管紧张素II的血管收缩作用和醛固酮分泌作用。其作用与血管紧张素II合成途径无关。阿齐沙坦对AT1受体的亲和力是AT2受体的10000倍以上。
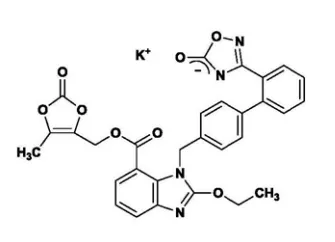
美阿沙坦钾化学结构式
2019年第十三届东方心脏病学会议上,武田公布了美阿沙坦钾针对中国高血压人群的III期临床研究(NCT02480764)结果。该研究共招募612 例原发性高血压患者,分别随机接受美阿沙坦钾80mg(n=209)、美阿沙坦钾40mg(n=199)或缬沙坦160mg(n=204)为期8周双盲治疗。研究终点包括第8周诊室血压谷值(上次给药后22-24小时)坐位收缩压(scSBP)、坐位舒张压(scDBP)较基线的变化和安全性。
研究结果显示,在第8周美阿沙坦钾80 mg组scSBP谷值下降幅度显着高于缬沙坦组(-24.2 vs -20.6 mm Hg;P=0.01),美阿沙坦钾40mg组 ScSBP谷值的下降幅度非劣于缬沙坦组(-22.5 vs. -20.6 mmHg,p=0.18)。
共有257例符合标准受试者被纳入ABPM(24小时动态血压监测)亚组分析。分析结果显示,在第8周,美阿沙坦钾40mg和80mg组0~24小时动态血压监测(8am~7am) SBP和DBP平均值均低于缬沙坦160mg组。
安全性方面,各治疗组治疗相关不良事件 (TEAEs)发生率相似(52.8%~56.5%),TEAEs一般为轻度或中度。最常见治疗相关的TEAE是头晕(美阿沙坦钾80mg组1.9%;美阿沙坦钾40mg组1.5%;缬沙坦组1.0%)。
基于以上研究结果,武田于2018年7月向NMPA提交美阿沙坦钾上市申请。
美阿沙坦钾最早于2011年获FDA批准上市。目前已在美国、加拿大、法国、英国等全球超过15个国家上市。医药魔方NextPharma数据库显示,2019年美阿沙坦钾为武田带来了767亿日元的营收,约合人民币48亿元。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










好文
93
#获批上市#
102
#武田#
71
#美阿沙坦钾片#
145