Cell Rep:大开眼界!肿瘤细胞竟是这样躲过免疫治疗的!
2018-07-13 Ruthy,Zoe 转化医学网
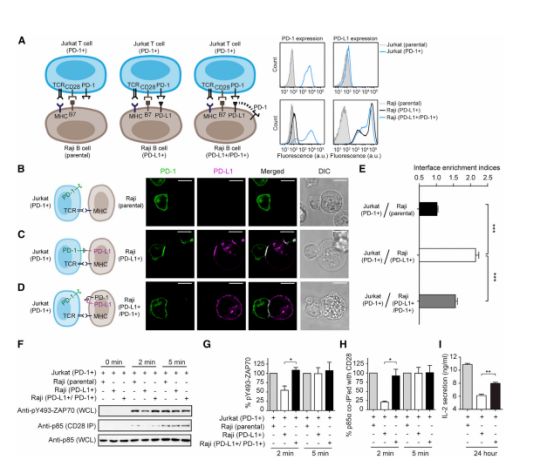
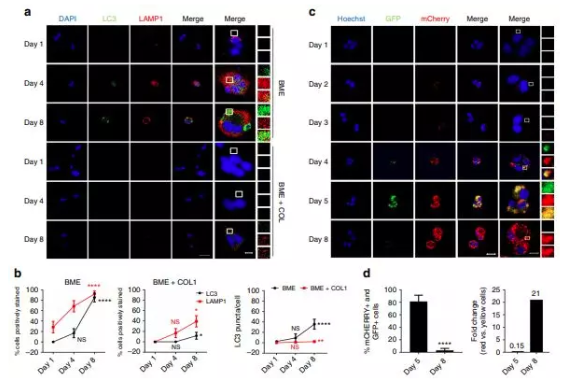
目前,以PD-1/PD-L1抑制剂为主的免疫疗法已成为肿瘤治疗领域的绝对热门,但是,PD-1 /PD-L1抑制剂在不同类型肿瘤病人中应用后,其效果却因人而异。科学家们曾认为这是受制于患者肿瘤细胞PD-L1的表达水平,然而,随着对PD-1 /PD-L1抑制剂疗法的深入研究,研究人员发现部分患者即使表达了高水平的PD-L1,PD-1 /PD-L1抑制剂仍无法有效治疗肿瘤。这是为什么呢?

作者:Ruthy,Zoe
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#CEL#
34
#Cell#
42
好好学习天天向上认真学习
83
好好学习天天向上认真学习
86
学习学习学习
92