红日药业口服PD-L1抑制剂获批临床
2019-11-17 佚名 医谷
近日,红日药业发布公告,近日收到国家药监局下发的临床试验通知书,公司申报的创新药艾姆地芬片符合有关要求,获准开展实体肿瘤临床试验。
据了解,红日药业的艾姆地芬片为国内首个获批临床试验的口服PD-L1小分子抑制剂,根据红日药业的公告,与目前已经获得批准上市的同靶点注射用单抗药物相比,艾姆地芬片具有能够透过细胞膜进入细胞内、在某种程度上可进入脑组织用于脑部肿瘤的治疗、可口服、患者顺应性强、可避免大分子药物引起的不良反应等优势,在生产工艺、剂型设计和给药方式等多种层面的研究也颇为成熟,成本低。
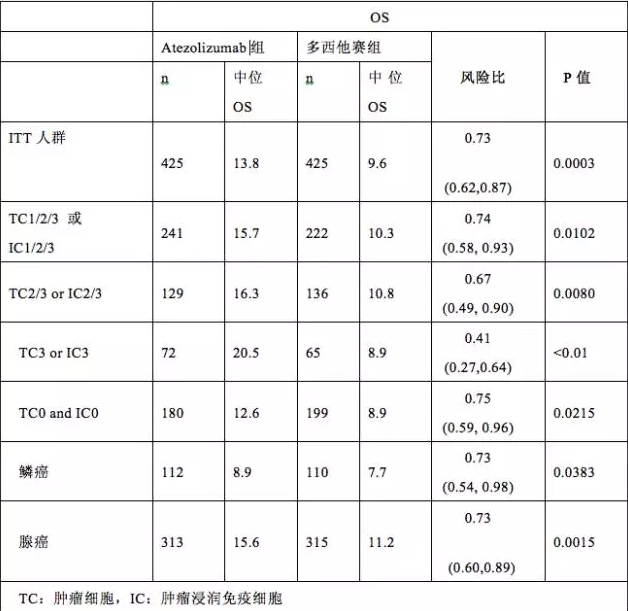
同靶点药物方面,目前国内外尚无已经获得批准上市的PD-L1小分子抑制剂,罗氏子公司基因泰克公司研发的阿特珠单抗(Tecentriq)简称“T药”,是美国FDA批准的首个PD-L1单抗药物,为PD-L1大分子抑制剂。罗氏2018年财报显示,T药的销售额为7.72亿瑞士法郎,同比增长59%。
另根据医药魔方NextPharma收录,全球有8款小分子PD-L1药物。国内仅有艾姆地芬片获批临床,其他都在临床前阶段。
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录






#口服PD-L1抑制剂#
74
#红日药业#
78
#PD-L1抑制剂#
74
#抑制剂#
82
#PD-L1#
71