国产新冠口服药VV116对比PAXLOVID三期临床试验获得成功
2022-05-24 君实生物 君实生物
2022年5月23日,君实生物与旺山旺水宣布VV116与辉瑞P药的头对头的三期临床获得成功 。
2022年5月23日,君实生物与旺山旺水宣布VV116与辉瑞P药的头对头的三期临床获得成功 。VV116 对比 PAXLOVID 早期治疗轻中度 COVID-19 的 III 期注册临床研究达到主要研究终点。

近日,上海君实生物医药科技股份有限公司(以下简称“公司”)控股子公 司上海君拓生物医药科技有限公司(以下简称“君拓生物”)与苏州旺山旺水生 物医药有限公司(以下简称“旺山旺水”)合作开发的产品口服核苷类抗 SARS-CoV-2 药物 VV116 片(项目代号:JT001/VV116,以下简称“VV116”)在一项 对比奈玛特韦片/利托那韦片(即 PAXLOVID)用于轻中度新型冠状病毒肺炎(以 下简称“COVID-19”)早期治疗的 III 期注册临床研究(NCT05341609)达到方 案预设的主要终点。
公司将于近期与监管部门沟通递交新药上市申请事宜。由于药品的研发周期长、审批环节多,容易受到一些不确定性因素的影响, 敬请广大投资者谨慎决策,注意防范投资风险。
临床试验进展情况(NCT05341609) NCT05341609 研究是一项多中心、单盲、随机、对照 III 期临床研究,旨在 评价 VV116 对比奈玛特韦片/利托那韦片(即 PAXLOVID)用于轻中度 COVID19 患者早期治疗的有效性和安全性。该项研究由上海交通大学医学院附属瑞金医院宁光院士担任主要研究者,实际入组 822 例患者,主要研究终点为“至持续临床恢复的时间”,次要研究终点包括“截至第 28 天发生 COVID-19 进展(定义为进展为重度/危重 COVID-19 或全因死亡)的受试者百分比”等。该临床研究结果显示,VV116 用于轻中度 COVID-19 的早期治疗达到临床 方案预设的主要终点。根据我国药品注册相关的法律法规要求,药物需完成临床研究并经国家药监 局审评。

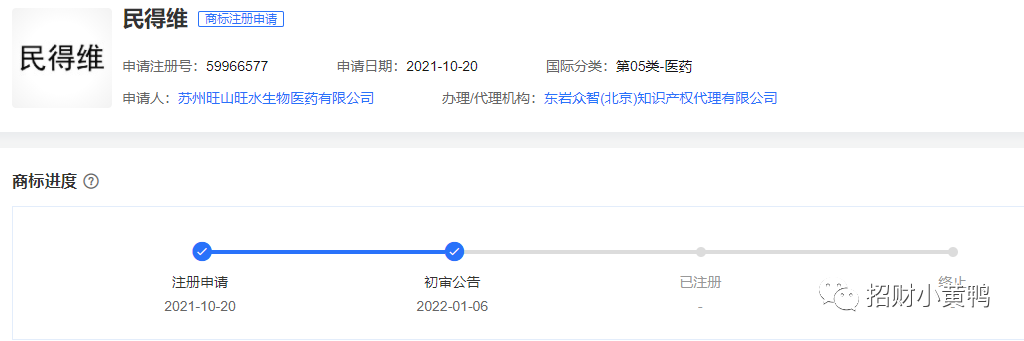
经查询,旺山旺水于2021年10月20日完成了第05类-医药的商标注册申请。
早前,renmindevir(VV116)乌兹别克斯坦售价公开,185美元,1243元人民币。
VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、旺山旺水生物医药有限公司、中国科学院中亚药物研发中心共同研发,正在中国和乌兹别克斯坦进行临床试验。
2021年10月4日,君实生物宣布,与旺山旺水生物医药有限公司达成合作,共同承担口服核苷类抗新冠病毒候选药物VV116在全球范围内的临床开发和产业化工作。中亚五国、俄罗斯、北非、中东四个区域归旺山旺水公司临床开发;全球其他区域由君实生物开发。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#口服药#
47
#三期临床试验#
51
#三期临床#
50
“paxlovid没有做出症状改善和安慰剂的差异,按照一般的认为就是没有做出差距。paxlovid临床症状改善跟安慰剂组是完全一样13天,而且安慰剂比它好一点”。上述人士认为。 简而言之,paxlovid在症状改善上跟安慰剂是非劣,然后现在VV116跟paxlovid在症状改变上也去比非劣,最后的结果是什么?即VV116在“症状改善上的临床终点”和安慰剂比是“非劣”——即只是不比安慰剂差而已。 “这个设计是一个荒唐的设计,就是说假如这么能通过审批的话,后面的药任何其他的药都很容易获批。”
57
研究注册中,没有任何地方提及是优效还是非劣效,说明研究设计本身就存在巨大的问题,至少不严谨
56