罗氏CD20xCD3双特异性抗体Mosunetuzumab治疗滤泡性淋巴瘤,获得FDA的突破性治疗指定
2020-07-15 MedSci原创 MedSci原创
Mosunetuzumab是CD20xCD3 T细胞双特异性抗体,靶向B细胞表面的CD20和T细胞表面的CD3。
罗氏公司宣布其CD20xCD3双特异性抗体mosunetuzumab治疗复发或难治性(R/R)滤泡性淋巴瘤患者,获得美国食品和药物管理局(FDA)授予的突破性治疗指定(BTD),这些患者先前已经接受了至少两种全身性疗法。
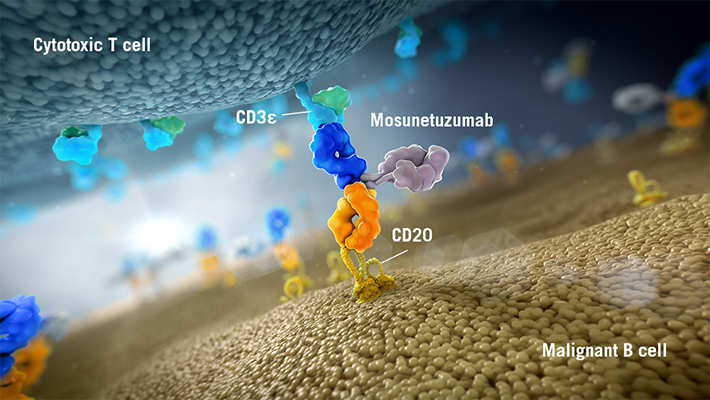
图片来源:https://www.biooncology.com/pipeline-molecules/mosunetuzumab.html
Mosunetuzumab是CD20xCD3 T细胞双特异性抗体,靶向B细胞表面的CD20和T细胞表面的CD3,通过双重靶向激活和重定向T细胞,并释放细胞毒性蛋白消灭目标B细胞。Mosunetuzumab具有与天然人抗体相似的结构,有两个“ Fab”区域,但不同于天然存在的抗体,因为一个“ Fab”区域靶向CD20,另一个“ Fab”区域靶向CD3。
目前mosunetuzumab正在临床开发中作为单一疗法或与其他药物结合使用,治疗CD20阳性B细胞非霍奇金淋巴瘤患者。
I/Ib期GO29781研究结果显示,mosunetuzumab在复发或难治性非霍奇金淋巴瘤患者中具有高应答率并实现了持久的完全缓解。FDA基于该结果,授予了BTD称号。
原始出处:
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CD20#
41
#突破性治疗指定#
32
#mAb#
40
#特异性#
28
#NET#
27