批准日期:2022年2月28日
批准机构:FDA
药物名称:Vonjo
活性成分:pacritinib
剂型:胶囊
CAS:937272-79-2
适应症:治疗伴有严重血小板减少症的骨髓纤维化患者
原研公司:CTI BioPharma
美国FDA宣布批准CTI BioPharma的Vonjo上市,治疗伴有严重血小板减少症的骨髓纤维化患者。Vonjo是一款新型的口服激酶抑制剂,能特异性抑制JAK2、IRAK1和CSF1R。因为它不抑制JAK1,因此可以避免抑制JAK1带来的潜在副作用。
该NDA将基于已完成的3期PERSIST-1和PERSIST-2试验以及2期PAC203剂量范围试验的可用数据。FDA已经同意滚动提交NDA,预计将在几周内开始。NDA提交预计在2021年第一季度完成。正在进行的3期PACIFICA试验预计将作为上市后承诺完成。
骨髓纤维化患者的血小板减少与内在疾病有关,但也已被证明与ruxolitinib治疗相关,这可能导致剂量减少,并因此可能会降低临床益处。停用ruxolitinib治疗的患者生存率进一步降低,平均总生存期为7个月至14个月。伴有严重血小板减少症的骨髓纤维化患者的治疗选择有限,这就造成了一个重要的医疗需求未得到满足的治疗领域。
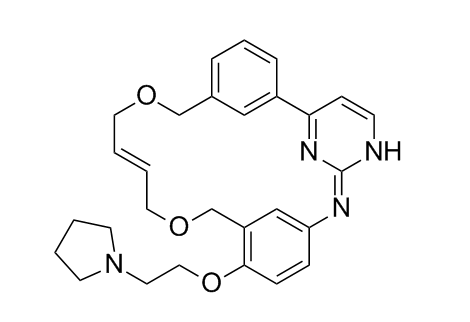
pacritinib化学结构式
(图片来源:medchemexpress.cn)
pacritinib是一款在研的口服激酶抑制剂,对JAK2、FLT3、IRAK1和CSF1R具有特异性。JAK家族的酶是信号转导途径中的核心成分,对正常血细胞生长发育、炎症细胞因子表达和免疫反应至关重要。这些激酶的突变已被证明与多种血液相关癌症的发生有直接关系,包括骨髓增生性肿瘤、白血病和淋巴瘤。
除骨髓纤维化外,由于对c-fms、IRAK1、JAK2和FLT3的抑制作用,pacritinib的激酶谱显示其对急性髓系白血病(AML)、骨髓增生异常综合征(MDS)、慢性粒单核细胞白血病(CMML)和慢性淋巴细胞白血病(CLL)具有潜在治疗作用。
◆ 2008年3月,pacritinib获得FDA授予治疗原发性骨髓纤维化(MF)、真性红细胞增多症后MF、原发性血小板增多症后MF的孤儿药资格(ODD)。
◆ 2014年8月,FDA授予pacritinib快速通道资格(FTD),用于治疗中危至高危骨髓纤维化患者,包括但不限于伴有疾病相关血小板减少症(血小板计数低)的患者、接受其他JAK2抑制剂治疗经历治疗期间出现的急性血小板减少症的患者、对其他JAK2疗法不耐受或症状控制不好(次优管理)的患者。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#FDA批准#
47
坚持学习
78
#ACR#
55
#骨髓纤维化#
103