Molecular Therapy Nucleic Acids:复旦团队研制出诱导型基因编辑ZFN靶向切除近10kb 全长HIV-1前病毒
2018-05-31 佚名 转化医学网
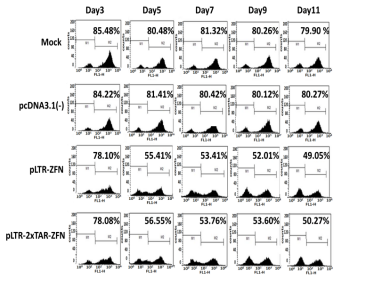
近日,复旦大学生命科学学院遗传工程国家重点实验室朱焕章课题组设计并构建出只在HIV感染细胞上才能切除HIV-1前病毒的诱导型锌指蛋白核酸酶(ZFN-Tat),避免了ZFN持续表达可能引起的潜在脱靶效应,为该技术在临床上安全、有效地应用奠定了基础。相关研究结果近日发表在国际知名期刊《Molecular Therapy- Nucleic Acids》
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#acid#
44
#CID#
40
#ERA#
42
学习
71
#复旦#
42