Nat Commun:RNF167靶向降解CASTOR1激活mTORC1促进肿瘤的发生发展
2021-02-25 xiaozeng MedSci原创
在约10%的癌症中丝氨酸/苏氨酸激酶AKT发生了突变,这很大程度的说明了其在癌症中的致癌作用。除了AKT基因突变外,生长因子上游信号通路的失调常常能够激活癌细胞中的AKT。
在约10%的癌症中丝氨酸/苏氨酸激酶AKT发生了突变,这很大程度的说明了其在癌症中的致癌作用。除了AKT基因突变外,生长因子上游信号通路的失调常常能够激活癌细胞中的AKT。
GSK3β、FOXO和TSC2是AKT的三个主要的下游基因,其能够介导AKT对不同刺激的响应并行使多种功能。既往研究显示,AKT介导的TSC2磷酸化和抑制作用已被认为是AKT激活mTORC1(雷帕霉素复合物1)的主要机制。
mTORC1是细胞响应生长因子和营养素进行细胞增殖的中心调控因子,其在癌症中表达失调。精氨酸能够激活mTORC1。
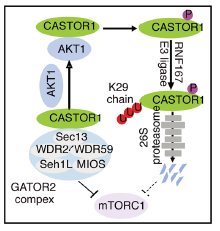
相关机制示意图
CASTOR1(mTORC1亚基1)是一种新发现的胞质精氨酸传感器,其可对精氨酸响应并调节mTORC1的活性。有趣的是,高水平的CASTOR1蛋白会抑制AAS(包括精氨酸)对mTORC1的激活。由于癌细胞常处于低营养水平状态,因此可能存在另一种机制来调控CASTOR1的表达。
在该研究中,研究人员发现E29泛素连接酶RNF167能够对CASTOR1进行K29连接的多泛素化和降解。此外,AKT能够介导CASTOR1 S14位点的磷酸化,显著增加其与RNF167的结合,促进其泛素化和降解,并降低其对MIOS的亲和力,从而导致mTORC1的激活。因此说明AKT可通过TSC2和CASTOR1依赖性途径来激活mTORC1。
RNF167介导的泛素化和AKT1介导的磷酸化促进乳腺癌的发生发展
进一步的研究显示,几种具有较高CASTOR1表达的细胞类型对精氨酸的调节并不敏感。值得注意的是,AKT和RNF167介导的CASTOR1降解能够激活独立于精氨酸的mTORC1,并最终促进乳腺癌的发生发展。
总而言之,该研究结果揭示了mTORC1的相关调节机制,并将RNF167鉴定为mTORC1失调相关疾病的治疗靶标。
原始出处:
Li, T., Wang, X., Ju, E. et al. RNF167 activates mTORC1 and promotes tumorigenesis by targeting CASTOR1 for ubiquitination and degradation. Nat Commun 12, 1055 (16 February 2021).
作者:xiaozeng
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#AST#
36
#Nat#
41
#NF1#
42
#发生发展#
42
#COMMUN#
37