【综述】| 老年三阴性乳腺癌患者的临床困境和系统治疗策略
2023-07-31 中国癌症杂志 中国癌症杂志
本文主要针对老年TNBC的流行病学、疾病生物学行为及特征、诊疗现状及未被满足的治疗需求等进行总结分析,并初步探索新型抗体药物偶联物在老年TNBC中的获益,以期为老年TNBC系统治疗策略的选择提供参考。
[摘要]
三阴性乳腺癌(triple-negative breast cancer,TNBC)缺乏明确的生物标志物,现有治疗手段以化疗为主,疗效有限且不良反应大。10%~21%的TNBC为老年患者,多伴随心、脑、肾疾病等诸多慢性合并症,对化疗耐受性差,是临床诊疗实践的一大难题。同时,专门针对老年TNBC患者的临床研究较少,导致这部分患者的安全及合理用药缺乏充足的循证医学证据,在疾病诊疗方面存在很多难点和争议。此外,老年TNBC有其特征,非肿瘤因素所致死亡率较高。因此,患者生存获益与生活质量及耐受性之间的平衡尤为重要。本文主要针对老年TNBC的流行病学、疾病生物学行为及特征、诊疗现状及未被满足的治疗需求等进行总结分析,并初步探索新型抗体药物偶联物(antibody-drug conjugate,ADC)在老年TNBC中的获益,以期为老年TNBC系统治疗策略的选择提供参考。
1.1 老年TNBC患者的临床定义
三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达阴性的乳腺癌,占全部乳腺癌的15%~20%[1]。随着人口老龄化的加剧,老年乳腺癌的发病率逐年上升,TNBC中老年患者占10%~21%[1-3]。
对于老年患者的年龄界定,尚无统一标准,多采用65或70岁作为年龄下限[4]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[5]建议应采用年龄分界线(≥65岁或≥70岁)来定义老年患者。多数发达国家将“65岁”定义为“老年人”[6]。《中国老年乳腺癌治疗专家共识(2018)》[7]采纳了2012版国际老年肿瘤学会和欧洲乳腺癌专家学会对老年乳腺癌的定义,并结合中国实际情况,将老年乳腺癌的年龄界定为≥70岁。乳腺癌国际组织(Breast International Group,BIG)也建议年龄界定为70岁[4]。在临床研究中,老年TNBC的年龄界限也不统一,较多研究[8-10]将≥65岁作为老年人群亚组划分标准,但也有研究[11-13]采用≥70岁或≥75岁。
1.2 老年TNBC患者的肿瘤生物学行为、分子分型及基因突变模式
老年TNBC患者除了肿瘤的高度异质性之外,由于发病年龄不同,在肿瘤生物学行为、分子分型及基因突变模式等方面均具有明显不同的疾病特征[14-15]。
老年TNBC患者肿瘤生物学行为不同。全球最大单中心多组学TNBC数据库的回顾性研究[16]显示,老年患者Ki-67增殖指数显著降低(P<0.05),严重纤维化水平更高(P=0.005)。乳腺癌组织的严重纤维化可能会导致对化疗的反应较低,因此研究者猜测纤维化可能是化疗药物渗透性较差的因素之一。
老年TNBC患者的分子分型也不同于年轻患者。根据国际六分型Lehmann/Pietenpol分型(P=0.004)和复旦大学附属肿瘤医院四分型FUSCC分型(P<0.001),不同年龄的TNBC患者具有不同的亚型分布特点,其中老年TNBC患者(≥65岁)中有将近一半属于管腔雄激素受体(luminal androgen receptor,LAR)亚型(FUSCC分型中占49%,Lehmann/Pietenpol分型中占42%)[16]。Aine等[14]也同样发现,LAR亚型主要集中在老年TNBC患者中,在60岁及以上患者中占比明显增加。此外,基因亚型分析显示,TNBC与基底样亚型密切相关,但在老年TNBC患者中基底样亚型占比较低,用PAM50乳腺癌基因表达谱检测法对3 947例TNBC患者检测确定的分子亚型显示,基底样亚型在21~39岁、50~59岁和70~93岁的患者中分别占44%、22%和9%[3]。
老年TNBC患者的基因突变模式也具有独特性:与年轻、中年患者相比,老年TNBC患者存在至少一个靶点突变/潜在突变的比例最高(8.0% vs 28.8% vs 59.5%,P<0.001),如PIK3CA、KMT2D、ERBB2和ERBB3突变率显著升高[16]。老年患者PIK3CA突变(年轻 vs 中年 vs 老年:0.0% vs 17.4% vs 31.0%,P=0.004)及磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号转导通路异常(年轻 vs 中年 vs 老年:8.0% vs 29.2% vs 54.8%,P<0.001)比例均较高[16]。其中PI3K/AKT/mTOR信号转导通路主要由PIK3CA突变或扩增、PTEN缺失或AKT突变激活而来,此信号转导通路的活化是引发TNBC治疗耐药并促进肿瘤细胞增殖转移的主要机制之一[17],可能与老年TNBC患者对某些靶向治疗不敏感相关。
2 老年TNBC患者的预后因素、治疗现状及未获满足的治疗需求
老年TNBC患者预后差,年龄及合并症是预后不良的重要因素[16,18]。一项纳入3 317例新发转移性乳腺癌患者的流调数据[19]显示,70岁以上患者的死亡率比40岁以下患者高8.48倍。Tzikas等[18]研究发现,与≤75岁的TNBC患者相比,>75岁的TNBC患者无复发生存期、远处无病生存期、乳腺癌特异性生存期和远处转移后的存活率均更差(P均<0.01)。基于老年患者风险增加后的主要因素分析,合并症是制约老年患者治疗和预后的重要影响因素。NCCN指南[5]提示老年人群的合并症负担重,肿瘤患者合并症数量随年龄增长而增加,55~64岁、65~74岁及75岁以上患者分别有10%、17%和27%伴有≥6种合并症。一项包含900多例早期乳腺癌患者的研究[20]显示,多种合并症患者死于合并症的风险是乳腺癌的20倍。另有研究[6]发现,合并症对65岁以上女性的生存影响最大。
由于专门针对老年肿瘤患者的研究较少,且大部分研究将该人群(尤其是伴随合并症的老年患者)排除在外,因此老年患者的治疗方案缺乏高级别循证医学证据。目前方案推荐主要基于有限的回顾性亚组分析和对来自年轻患者研究结果的推测[20],化疗仍是临床实践中老年TNBC患者主要的系统治疗方案[18]。由于伴随合并症、多种药物合用的禁忌证及身体虚弱或肝肾功能不全等,老年患者对化疗耐受性较差。虽然整体认为老年TNBC患者可以从化疗中获益,但有研究[10]发现,伴随合并症的患者接受化疗比例较低,体能状态较差的老年患者伴随更多化疗剂量减少及治疗中断。老年患者选择化疗方案时需要考虑合并症对耐受性的影响,以及合并症治疗药物与化疗方案的相互作用等[21-22]。
因此,老年TNBC患者在确定治疗方案并开始治疗前,建议先进行彻底的药物审查,条件允许时建议邀请临床药剂师共同参与[9]。应仔细评估患者对抗肿瘤系统治疗的耐受性,以便更好地平衡药物疗效和安全性。老年TNBC患者的合理用药选择,即如何在保证安全性及耐受性的前提下使患者生存获益最大化,成为临床实践中未获满足的巨大治疗需求。
3 老年TNBC患者的系统治疗方案选择和用药管理
3.1 老年早期TNBC患者新辅助治疗/辅助治疗的选择及安全性管理
化疗可以给老年早期TNBC患者带来生存获益。Crozier等[23]基于美国国家癌症数据库16 026例患者的癌症数据证实,接受化疗较未接受化疗患者的总生存期(overall survival,OS)获益提高(HR=0.69,95% CI:0.60~0.80,P<0.000 1)。对于一般状况良好的老年TNBC患者,新辅助化疗的最佳方案选择尚存在争议,可以选择蒽环类药物和紫杉烷序贯的治疗方案,但没有足够的循证医学证据支持。关于含铂方案,目前也没有明确的推荐建议。鉴于铂类药物的肝肾毒性等不良反应,大多数老年TNBC患者可能无法耐受含铂化疗药物[23]。在辅助治疗的选择上,来自英国的大型回顾性研究[24]分析了2002—2012年10 000例70岁以上的乳腺癌患者,2002年后随着化疗使用率增加,乳腺癌死亡率随之降低。另外,有研究[10]显示,50—69岁老年乳腺癌患者接受辅助治疗后复发风险降低20%,死亡风险降低11%,提示一般状况良好的老年TNBC患者可以从辅助化疗中获益。
化疗的不良反应较大,可能极大地影响老年TNBC患者的规范用药。美国国立癌症研究所监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results,SEER)数据库的资料[22]显示,66~70岁接受辅助蒽环类药物治疗的患者10年内心力衰竭发生率显著高于未接受辅助化疗的患者(38% vs 28%)。化疗常见不良反应谱较广泛,包括胃肠道不适、骨髓抑制、发热等[7],均可能会严重影响老年乳腺癌患者的生活质量。Oladipo等[25]探索65岁及以上乳腺癌患者接受辅助化疗的安全性,78.2%的老年患者达到了预期剂量强度和可控不良反应,23.8%的患者需要住院处理化疗相关不良反应。因此,老年TNBC患者接受新辅助治疗/辅助治疗的比例明显较低[10]。Tzikas等[18]研究发现,与<40岁的年轻患者相比,>74岁的老年患者接受新辅助化疗/辅助化疗的比例显著较低(96% vs 12%)。Kaplan等[26]对771例TNBC患者的研究也显示,随着患者年龄增加,接受新辅助化疗/辅助化疗的比例显著降低(25~64岁 vs 65~74岁 vs 75岁以上:95% vs 76% vs 39%)。
免疫治疗和靶向治疗TNBC也有诸多早期探索性研究。KEYNOTE-522研究[27]纳入未经治疗的Ⅱ~Ⅲ期TNBC患者,分别接受新辅助化疗联合帕博利珠单抗(术后接受帕博利珠单抗辅助治疗)和单纯新辅助化疗(术后接受安慰剂辅助治疗)。帕博利珠单抗组和安慰剂组主要终点的病理学完全缓解(pathological complete response,pCR)率分别为64.8%和51.2%(P <0.001),其中老年患者(≥65岁)占11.8%,但未进行具体数据分析。此外Ⅰb期KEYNOTE-173研究[28]和Ⅲ期IMpassion031研究[29]对免疫治疗联合新辅助化疗用于TNBC患者的有效性和安全性进行了探索,观察到pCR获益。两项研究虽纳入了老年患者,但均未进一步分析年龄相关获益。老年TNBC患者能否从免疫治疗中获益仍缺乏相关证据。
多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂可使BRCA突变患者获益,促进了其在早期乳腺癌患者中的应用进展。纳入634例患者的Ⅲ期BrightTNess研究[30]显示,在TNBC新辅助化疗中维利帕利联合卡铂和紫杉醇组的pCR率(53%)显著高于紫杉醇组(31%),但卡铂联合紫杉醇组的pCR率达到58%,说明加入维利帕利并未改善患者获益,而联合卡铂后3~4级血液学毒性显著增加。Ⅱ期GeparOLA研究[31]发现,在TNBC中奥拉帕利组和卡铂组的pCR率接近(56.0% vs 59.3%),在意向性治疗(intention-to-treat,ITT)人群中,奥拉帕利组相较于卡铂组在年龄<40岁的患者中pCR率更高(76.2% vs 45.5%),而在≥40岁的患者中pCR率较低(45.8% vs 50.0%)。因此,在老年早期TNBC患者中,奥拉帕利能否获益值得进一步探索。
在老年早期TNBC的系统治疗中,化疗仍占主导地位,但化疗导致的不良反应大,接受化疗的比例及足剂量比例均较低,而免疫治疗及PARP抑制剂治疗在老年早期TNBC患者中的获益仍不明确。国际老年肿瘤学会指南[20]指出,化疗的选择不应仅基于年龄,还应该考虑预估的患者绝对获益、预期的寿命、对治疗耐受性和患者意愿等因素。《中国老年乳腺癌治疗专家共识(2018)》[7]指出,对于一般情况良好、无基础疾病的老年患者,可遵循一般年龄组人群的相应指南给予标准方案和疗程的辅助化疗,但老年患者如伴有合并症或一般情况较差时,可综合考虑身体及耐受情况,适当调整化疗药物的剂量强度。因此,老年早期TNBC患者,尤其是伴随合并症或一般状况较差的患者,临床急需疗效显著且安全性及耐受性更好的新型药物。
3.2 晚期复发或转移性老年TNBC患者的药物选择及安全性管理
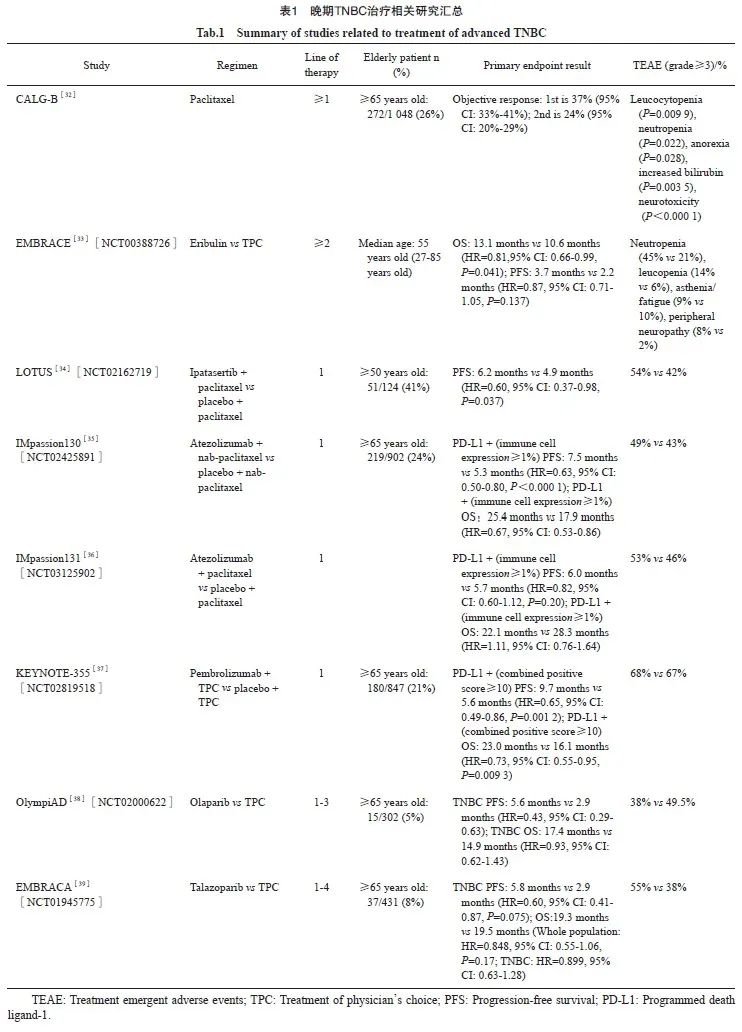
晚期乳腺癌患者的治疗目标是在延长生存期的前提下,尽可能保证患者的生活质量。高龄是晚期癌症相关死亡(诊断后1个月内)的风险因素[3],且由于并发症或耐受性问题,老年患者不能完全参照指南接受治疗,临床实践中可能存在治疗过度或不足的问题。老年患者通常不太接受牺牲生活质量和机体功能来换取可能的生存获益[20]。当老年患者出现疾病进展并需要进一步治疗时,如何平衡生存获益及生活质量与耐受性之间的关系变得尤为重要,这成为临床决策需要慎重考虑的问题。晚期TNBC治疗相关研究汇总见表1。
老年转移性TNBC(metastatic TNBC,mTNBC)患者通常可以从化疗中获益,且首选单药治疗,联合方案未显示出可延长OS且不良反应更大[22]。蒽环类药物和紫衫类药物仍是晚期mTNBC一线治疗方案的首选药物。一项针对老年转移型乳腺癌患者(≥60岁)的Ⅲ期研究[6]显示,蒽环类药物在转移型乳腺癌一线治疗时需注意心脏毒性问题。纳入1 048例患者的CALG-B研究[32]显示,紫杉醇引起的3级神经毒性发生率随着年龄增长而增加,二线治疗中≥65岁患者出现神经毒性的时间最短。此外,在老年TNBC患者中,多柔比星、长春瑞滨和吉西他滨单药一线治疗的效果较卡培他滨、艾立布林二线和三线治疗更好,可能与患者的基线体力状态或耐受性较好有关。老年mTNBC患者,尤其对于有慢性疾病合并症的患者,如何选择疗效、安全性和耐受性良好的药物,仍是临床亟待探索的方向。
免疫治疗和靶向治疗老年mTNBC中也开展了多项探索。最新的欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)转移性乳腺癌诊疗规范指南[40]建议根据生物标志物表达状态选择mTNBC一线治疗方案,但免疫治疗在TNBC中的生存获益仍然存在争议。IMpassion130研究[35]显示,ITT人群中≥65岁的mTNBC患者(约占24%)阿替利珠单抗联合化疗组的中位OS相对于安慰剂联合化疗组显示出一定获益(HR=0.78,95% CI:0.55~1.12),程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)阳性(免疫细胞表达≥1%)患者获益更多(HR=0.54,95% CI:0.29~0.98),且HR值均优于<65岁患者;KEYNOTE-355研究[37]显示,帕博利珠单抗联合化疗对比安慰剂联合化疗的无进展生存期(progression-free survival,PFS)获益在ITT人群≥65岁患者组(约占21%)中的HR值优于<65岁患者组(0.72 vs 0.83),综合阳性评分≥10的患者中≥65岁与<65岁的HR值接近(0.67 vs 0.63)。两项研究的HR值纵向对比显示,≥65岁的老年患者获益略优于<65岁人群,但研究未对不同年龄患者进行直接组间对比,因此不能断定免疫治疗可使老年患者获益,有待进一步探索。基于IMpassion131研究[36]与Impassion130研究[35]的获益结论相悖,并未显示生存获益且未对年龄进一步探索,瑞士Roche公司主动向美国食品药品管理局(Food and Drug Administration,FDA)申请撤回阿替利珠单抗mTNBC一线治疗适应证,中国也尚未获批免疫药物在TNBC中的适应证[41]。TNBC患者中仅40%表达PD-L1,不到20%的患者表现出从免疫治疗中获益[42-43],而且老年TNBC患者肿瘤浸润淋巴细胞评分低于30%的比例较高(≥60岁的患者 vs <40岁的患者:73.5% vs 46.2%)[14],这在一定程度上限制了老年患者的获益人群。
此外免疫治疗联合化疗的治疗方案也存在耐受性问题,阿替利珠与帕博利珠单抗研究中发生3级以上不良反应的患者比例高达50%~78%,停药率为16%~18%,减药率高达40%[35,37],免疫治疗通过调节T细胞活性所导致的免疫激活,可引起免疫相关不良反应,如心肌炎、肺炎、结肠炎和神经系统不良反应,严重时可能威胁生命[44],对于老年患者来说也是一大挑战。
PARP抑制剂研究虽然显示出PFS获益,但无OS获益,且没有老年乳腺癌患者的数据。NCCN、ESMO等指南[40,45]推荐在BRCA突变的mTNBC患者中使用PARP抑制剂。OlympiAD研究[38]显示,奥拉帕利对比化疗可显著改善TNBC亚组患者的PFS(5.6个月 vs 2.9个月,HR=0.43);EMBRACA研究[39]显示,他拉唑帕利能为TNBC亚组患者带来PFS获益(5.8个月 vs 2.9个月,HR=0.60,P=0.075),但遗憾的是这两项研究均未能带来OS获益。两项研究入组患者中≥65岁的患者数均较少,分别只有15例(5%)和37例(8%)。同时,研究中同样存在部分患者耐受性的问题,55%~78%的患者发生严重不良反应,4.9%~6.2%的患者因不良反应而停药,25.4%~66.0%的患者需要剂量调整。而且TNBC中仅约10%的患者携带BRCA突变[46],老年患者BRCA1突变比例(年轻患者 vs 中年患者 vs 老年患者:28.0% vs 7.6% vs 0.0%,P=0.02)和同源重组缺陷比例(年轻患者 vs 中年患者 vs 老年患者:59.1% vs 49.7% vs 15.4%)与年轻患者相比均较低[16]。因此老年人群能否从PARP抑制剂治疗中获益仍需要进一步探索。
3.3 抗体药物偶联物(antibody-drug conjugate,ADC)在老年TNBC患者中的新探索
近年来,乳腺癌进入了ADC治疗时代。ADC兼具靶向药物的精准及载药的强效,疗效好,且安全性和耐受性良好。ADC以高亲和力特异性靶向结合肿瘤细胞表面抗原,通过内吞、裂解并释放有效载荷药物,直接杀伤肿瘤细胞,其精准靶点与细胞毒药物的独特结构,实现了 “生物导弹”的梦想,而靶向精准带来优于化疗药物的安全性及耐受性。早期ADC研发靶点更多集中于HER2,但HER2阳性人群仅占乳腺癌的15%~20%,获益人群有限。近年来,靶向人滋养细胞表面抗原-2(trophoblast cell-surface antigen-2,TROP-2)的新型ADC备受关注,成为实体瘤研发的热点。
T-DXd(DS-8201)是一种HER2 ADC,由人源化抗HER2单克隆抗体、可裂解的马来酰亚胺甘氨酸-苯丙氨酸-甘氨酸四肽链接键和DNA拓扑异构酶Ⅰ抑制剂伊喜替康甲磺酸盐(DX-8951f)衍生物DXd组成[47],DXd具有高度的膜通透性,对HER2低表达肿瘤细胞表现出“旁观者效应”进一步扩大药物作用范围。2019年美国FDA批准DS-8201用于治疗不可手术切除或已使用过2种或多种抗HER2靶向治疗后疾病进展的HER2阳性晚期乳腺癌。其在HER2低表达乳腺癌患者中也进行了探索,DS8201-A-J101研究[48]在HER2低表达乳腺癌患者中显示出初步抗肿瘤活性,整体客观缓解率(objective response rate,ORR)为37%,但进一步亚组分析显示,7例(13%)TNBC患者的ORR仅14.3%。Ⅱ期DAISY研究[49]旨在通过广泛的生物标志物分析评估T-DXd单药在晚期乳腺癌患者中的疗效,研究分为3个队列,分别为HER2高表达[免疫组织化学(immunohistochemistry,IHC)3+或IHC2+/原位杂交(in situ hybridization,ISH)+,队列1)]、HER2低表达(IHC2+/ISH-或IHC1+,队列2)和HER2未检出(IHC0+,队列3),研究中包含15%(27/179)的TNBC患者,在激素受体阴性亚组分析中,HER2低表达TNBC患者的PFS优于HER2不表达TNBC患者(3.5个月 vs 2.1个月),但两者均显著低于HER2过表达的激素受体阴性患者(12.2个月)。之后开展的Ⅲ期DESTINY-Breast04研究[50],探索T-DXd对比医师选择化疗方案(treatment of physician’s choice,TPC)在HER2低表达乳腺癌患者中的疗效和安全性,总体人群中,T-DXd组的PFS和OS较TPC组显著延长,中位PFS分别为9.9和5.1个月(HR=0.50,P<0.001),中位OS分别为23.4和16.8个月(HR=0.64,P=0.001);但基于前期研究中激素受体阳性人群获益优于TNBC人群,此研究主要终点聚焦在激素受体阳性人群中, TNBC仅入组63例(11.3%)。以上研究均显示, T-DXd能为HER2低表达乳腺癌患者带来一定获益,但入组的TNBC患者较少,且未对年龄进行分析,在老年TNBC中的应用需要进一步验证。鉴于这项研究均有致死性药物特异性不良反应间质性肺炎发生,在老年患者中应用更需要谨慎。
2021年戈沙妥珠单抗作为首个以TROP-2为靶点的ADC,获美国FDA批准用于晚期TNBC的治疗。戈沙妥珠单抗由特定环境下可水解的CL2A连接子将靶向TROP-2抗原的人源化免疫球蛋白G1(immunoglobulin G1,IgG1)抗体和化疗药物伊立替康的代谢活性产物SN-38偶联而成[51]。SN-38也可以通过经内吞后再次透膜,或直接在肿瘤微环境内释放,两种方式杀伤临近肿瘤细胞,发挥“旁观者效应”[52]。在正常生理pH值下,SN-38均以非葡萄糖醛酸化的活性形式存在,且具有封闭的内酯环直至释放,可以最大限度地发挥治疗作用,同时能显著降低毒性[53],尤其对老年患者,能够降低药物毒性对身体的损伤,提高患者的耐受性和生活质量。
2022年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)大会公布的Ⅲ期ASCENT研究[54]结果显示,529例患者中, 468例基线检查未发现脑转移,中位年龄为54岁(27~82岁),戈沙妥珠单抗治疗既往接受过至少二线化疗(至少一线用于复发转移阶段)的mTNBC患者,与TPC(艾日布林、长春瑞滨、卡培他滨或吉西他滨)相比能显著改善mTNBC患者的中位PFS(5.6个月 vs 1.7个月,HR=0.39, 95% CI:0.31~0.49,P<0.000 1),同时能显著延长中位OS(12.1个月 vs 6.7个月,HR=0.48;95% CI:0.38~0.59,P<0.000 1)。TROP-2在正常组织中几乎不表达,在多种上皮肿瘤细胞中呈高表达或中表达,尤其TNBC中表达比例约88%,有研究[42]显示,戈沙妥珠单抗的疗效不受TROP-2表达和BRCA突变状态的影响,ORR和PFS均全面获益,故NCCN指南[45]不推荐TROP-2常规检测。基于较好的疗效,多项指南[40,45,54-55]均推荐将戈沙妥珠单抗作为TNBC晚期二线治疗的优选方案。
ASCENT研究包含44例(19%)年龄≥65岁的患者接受戈沙妥珠单抗治疗,与TPC相比,ORR(50% vs 0%)和临床获益率(61% vs 9%)显著更高,PFS(7.1个月 vs 2.4个月,HR=0.22,95% CI:0.12~0.40)和OS(15.3个月 vs 8.2个月,HR=0.37;95% CI:0.22~0.64)显著延长,其中7例≥75岁的患者中,2例部分缓解,4例疾病稳定,1例疾病稳定>6个月最佳缓解。在安全性方面,≥65岁以上的患者戈沙妥珠单抗剂量调整(35% vs 33%)和终止治疗(2% vs 2%)的发生率与对照组相当,导致剂量降低的主要不良反应包括中性粒细胞减少症(14% vs 25%)、疲劳(10% vs 4%)、腹泻(6% vs 0%)和恶心(4% vs 0%)[56],戈沙妥珠单抗耐受性良好,无治疗相关死亡病例,整体不良反应可控。2021年圣安东尼奥乳腺癌研讨会(San Antonio Breast Cancer Symposium,SABCS)上更新的生活质量结果[57]显示,无论应答状态如何,戈沙妥珠单抗治疗组患者的健康相关性生命质量(health-related quality of life,HRQoL)变化趋势均优于化疗组,不良反应未对总体生活质量或功能产生负面影响。由此可见,戈沙妥珠单抗在二线及二线以上老年mTNBC患者(≥65岁)中获益明确,不良反应安全可控,同时安全性相比于化疗、其他免疫治疗和靶向治疗优势显著,有望成为老年晚期TNBC患者的优选方案。
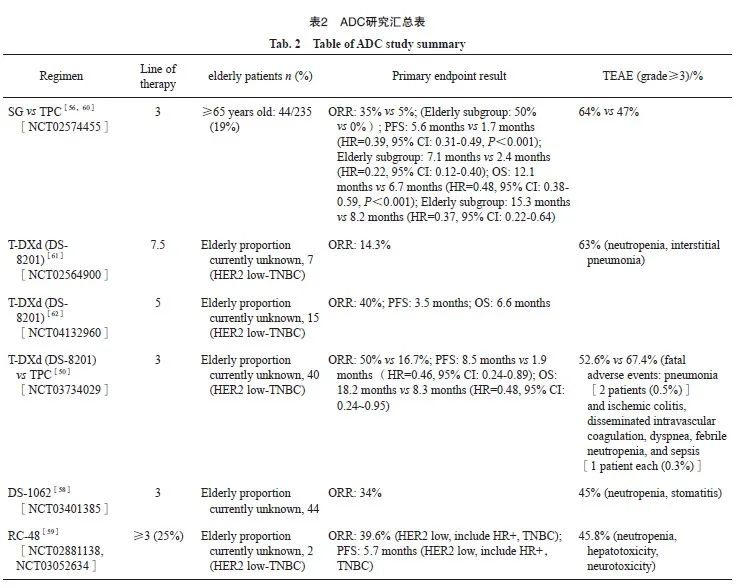
此外,还有多种ADC处于研发中,详见表2。如以TROP-2为靶点ADC datopotamab deruxtecan( DS-1062)Ⅰ期TROPION-PanTumor01研究[58]和以HER2为靶点的RC48的两项Ⅰ期汇总研究[59]均显示出在HER2低表达或TNBC中有一定获益,虽然尚未有确证性的数据,但是可以期待其未来披露更多相关数据,为老年TNBC的治疗提供更多策略。
4 总结与展望
老年TNBC在乳腺癌人群中占10%~21%,通常多以65岁或70岁作为年龄下限界定。老年TNBC存在与年龄相关的独特生物学特征,如TNBC亚型分布不同(LAR亚型更多),或特定基因变异谱不同、信号通路的突变。目前老年TNBC治疗没有标准方案,仍以化疗为主。但临床实践中,由于体能状态较差、耐受性差等原因,老年患者接受新辅助化疗和辅助化疗的比例较低;晚期复发或转移后接受化疗期间存在的安全性及耐受性等问题,成为临床诊疗的巨大挑战。另外,由于老年TNBC患者大多数存在较多合并疾病,在抗肿瘤治疗时需平衡性考虑药物疗效及安全性问题。
免疫治疗及PARP抑制剂是否能带来生存获益尚存在争议,且缺乏老年乳腺癌患者的研究数据。ADC独特的分子设计和药代动力学特征可能成为肿瘤治疗领域一类非常有前途的药物,DS-8201、DS-1062和RC48等Ⅰ/Ⅱ期研究在TNBC中展现出一定获益,但TNBC入组患者较少,缺乏可靠性,期待未来更多的研究探索。戈沙妥珠单抗作为首个TROP-2 ADC,已被美国FDA和中国国家药品监督管理局批准用于治疗接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或mTNBC患者。ASCENT研究[54,56]显示,戈沙妥珠单抗在TNBC中的疗效及耐受性良好,且在二线及二线以上老年mTNBC患者(≥65岁)中,戈沙妥珠单抗较化疗方案也显示出显著获益,耐受性良好,整体不良反应可控,且能显著提升患者总体的生活质量,或可成为晚期老年TNBC患者的优选方案。未来急需更多针对老年TNBC患者的药物探索,积累更多疗效、安全性及耐受性的循证医学证据,从而推动老年TNBC诊疗的发展。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1]HWANG S Y, PARK S, KWON Y. Recent therapeutic trends and promising targets in triple negative breast cancer[J]. Pharmacol Ther, 2019, 199: 30-57.
[2]BAUER K R, BROWN M, CRESS R D, et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California cancer registry[J]. Cancer, 2007, 109(9): 1721-1728.
[3]SHACHAR S S, JOLLY T A, JONES E, et al. Management of triple-negative breast cancer in older patients: how is it different?[J]. Oncology (Williston Park), 2018, 32(2): 58-63.
[4]DEPBOYLU B. Treatment and patient related quality of life issues in elderly and very elderly breast cancer patients[J]. Transl Cancer Res, 2020, 9(Suppl 1): S146-S153.
[5]CARLSON R W, MOENCH S, HURRIA A, et al. NCCN Task force report: breast cancer in the older woman[J]. J Natl Compr Canc Netw, 2008, 6(Suppl 4): S1-S27.
[6]EXTERMANN M, BALDUCCI L, LYMAN G H. What threshold for adjuvant therapy in older breast cancer patients?[J]. J Clin Oncol, 2000, 18(8): 1709-1717.
[7]中国老年乳腺癌治疗共识专家组. 中国老年乳腺癌治疗专家共识(2018)[J]. 协和医学杂志, 2018, 9(4): 307-312.
Expert Group for Treatment of Breast Carcinoma in Eldly Chinese Patients. Consensus on the treatment of breast carcinoma in elderly Chinese patients (2018)[J]. Med J Peking Union Med Coll Hosp, 2018, 9(4): 307-312.
[8]MOHILE S G, DALE W, SOMERFIELD M R, et al. Practical assessment and management of vulnerabilities in older patients receiving chemotherapy: ASCO guideline for geriatric oncology[J]. J Clin Oncol, 2018, 36(22): 2326-2347.
[9]BIGANZOLI L, CINIERI S, BERARDI R, et al. EFFECT: a randomized phase Ⅱ study of efficacy and impact on function of two doses of nab-paclitaxel as first-line treatment in older women with advanced breast cancer[J]. Breast Cancer Res, 2020, 22(1): 83.
[10]GIORDANO S H, DUAN Z G, KUO Y F, et al. Use and outcomes of adjuvant chemotherapy in older women with breast cancer[J]. J Clin Oncol, 2006, 24(18): 2750-2756.
[11]ZHU W J, PEREZ E A, HONG R X, et al. Age-related disparity in immediate prognosis of patients with triple-negative breast cancer: a population-based study from SEER cancer registries[J]. PLoS One, 2015, 10(5): e0128345.
[12]YOON J, KNAPP G, QUAN M L, et al. Cancer-specific outcomes in the elderly with triple-negative breast cancer: a systematic review[J]. Curr Oncol, 2021, 28(4): 2337-2345.
[13]JEON Y W, YOU S H, LEE J E, et al. Optimal treatment of breast cancer in women older than 75 years: a Korea breast cancer registry analysis[J]. Breast Cancer Res Treat, 2019, 178(3): 693-701.
[14]AINE M, BOYACI C, HARTMAN J, et al. Molecular analyses of triple-negative breast cancer in the young and elderly[J]. Breast Cancer Res, 2021, 23(1): 20.
[15]TICHY J R, LIM E, ANDERS C K. Breast cancer in adolescents and young adults: a review with a focus on biology[J]. J Natl Compr Canc Netw, 2013, 11(9): 1060-1069.
[16]MA D, JIANG Y Z, XIAO Y, et al. Integrated molecular profiling of young and elderly patients with triple-negative breast cancer indicates different biological bases and clinical management strategies[J]. Cancer, 2020, 126(14): 3209-3218.
[17]OCANA A, VERA-BADILLO F, AL-MUBARAK M, et al. Activation of the PI3K/mTOR/AKT pathway and survival in solid tumors: systematic review and meta-analysis[J]. PLoS One, 2014, 9(4): e95219.
[18]TZIKAS A K, NEMES S, LINDERHOLM B K. A comparison between young and old patients with triple-negative breast cancer: biology, survival and metastatic patterns[J]. Breast Cancer Res Treat, 2020, 182(3): 643-654.
[19] VAZ-LUIS I, LIN N U, KEATING N L, et al. Factors associated with early mortality among patients with de novo metastatic breast cancer: a population-based study[J]. Oncologist, 2017, 22(4): 386-393.
[20] BIGANZOLI L, WILDIERS H, OAKMAN C, et al. Management of elderly patients with breast cancer: updated recommendations of the International Society of Geriatric Oncology (SIOG) and European Society of Breast Cancer Specialists (EUSOMA)[J]. Lancet Oncol, 2012, 13(4): e148-e160.
[21] YANCIK R, WESLEY M N, RIES L A, et al. Effect of age and comorbidity in postmenopausal breast cancer patients aged 55 years and older[J]. JAMA, 2001, 285(7): 885-892.
[22] AAPRO M, WILDIERS H. Triple-negative breast cancer in the older population[J]. Ann Oncol, 2012, 23(Suppl 6): vi52-vi55.
[23] CROZIER J A, PEZZI T A, HODGE C, et al. Addition of chemotherapy to local therapy in women aged 70 years or older with triple-negative breast cancer: a propensity-matched analysis[J]. Lancet Oncol, 2020, 21(12): 1611-1619.
[24] WARD S E, HOLMES G R, RING A, et al. Adjuvant chemotherapy for breast cancer in older women: an analysis of retrospective English cancer registration data[J]. Clin Oncol (R Coll Radiol), 2019, 31(7): 444-452.
[25] OLADIPO O, COYLE V, MCALEER J J, et al. Achieving optimal dose intensity with adjuvant chemotherapy in elderly breast cancer patients: a 10-year retrospective study in a UK institution[J]. Breast J, 2012, 18(1): 16-22.
[26] KAPLAN H G, MALMGREN J A, ATWOOD M K. Triplenegative breast cancer in the elderly: prognosis and treatment[J]. Breast J, 2017, 23(6): 630-637.
[27] SCHMID P, CORTES J, PUSZTAI L, et al. Pembrolizumab for early triple-negative breast cancer[J]. N Engl J Med, 2020, 382(9): 810-821.
[28] SCHMID P, SALGADO R, PARK Y H, et al. Pembrolizumab plus chemotherapy as neoadjuvant treatment of high-risk, early-stage triple-negative breast cancer: results from the phase 1b open-label, multicohort KEYNOTE-173 study[J]. Ann Oncol, 2020, 31(5): 569-581.
[29] PROF, ELIZABETH A, MITTENDORF, et al. Neoadjuvant atezolizumab in combination with sequential nab-paclitaxel and anthracycline-based chemotherapy versus placebo and chemotherapy in patients with early-stage triple-negative breast cancer (IMpassion031): a randomised, double-blind, phase 3 trial[J]. Lancet, 2020, 396(10257): 1090-1100.
[30] LOIBL S, O'SHAUGHNESSY J, UNTCH M, et al. Addition of the PARP inhibitor veliparib plus carboplatin or carboplatin alone to standard neoadjuvant chemotherapy in triple-negative breast cancer (BrighTNess): a randomised, phase 3 trial[J]. Lancet Oncol, 2018, 19(4): 497-509.
[31] FASCHING P A, LINK T, HAUKE J, et al. Neoadjuvant paclitaxel/olaparib in comparison to paclitaxel/carboplatinum in patients with HER2-negative breast cancer and homologous recombination deficiency (GeparOLA study)[J]. Ann Oncol, 2021, 32(1): 49-57.
[32] LICHTMAN S M, HURRIA A, CIRRINCIONE C T, et al. Paclitaxel efficacy and toxicity in older women with metastatic breast cancer: combined analysis of CALGB 9342 and 9840[J]. Ann Oncol, 2012, 23(3): 632-638.
[33] CORTES J, O’SHAUGHNESSY J, LOESCH D, et al. Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 openlabel randomised study[J]. Lancet, 2011, 377(9769): 914-923.
[34] KIM S B, DENT R, IM S A, et al. Ipatasertib plus paclitaxel versus placebo plus paclitaxel as first-line therapy for metastatic triple-negative breast cancer (LOTUS): a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial[J]. Lancet Oncol, 2017, 18(10): 1360-1372.
[35] SCHMID P, RUGO H S, ADAMS S, et al. Atezolizumab plus nab-paclitaxel as first-line treatment for unresectable, locally advanced or metastatic triple-negative breast cancer (IMpassion130): updated efficacy results from a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2020, 21(1): 44-59.
[36] MILES D, GLIGOROV J, ANDRÉ F, et al. Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase Ⅲ trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer[J]. Ann Oncol, 2021, 32(8): 994-1004.
[37] CORTES J, CESCON D W, RUGO H S, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial[J]. Lancet, 2020, 396(10265): 1817-1828.
[38] ROBSON M, IM S A, SENKUS E, et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation[J]. N Engl J Med, 2017, 377(6): 523-533.
[39] LITTON J K, RUGO H S, ETTL J, et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation[J]. N Engl J Med, 2018, 379(8): 753-763.
[40] GENNARI A, ANDRÉ F, BARRIOS C H, et al. ESMO clinical practice guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer[J]. Ann Oncol, 2021, 32(12): 1475-1495.
[41] 李健斌, 江泽飞. 2021年中国临床肿瘤学会乳腺癌诊疗指南更新要点解读[J]. 中华医学杂志, 2021, 101(24): 1835-1838.
LI J B, JIANG Z F. Chinese Society of Clinical Oncology breast cancer guideline version 2021: updates and interpretations [J]. Natl Med J China, 2021, 101(24): 1835-1838.
[42]BARDIA A, TOLANEY S M, PUNIE K, et al. Biomarker analyses in the phase Ⅲ ASCENT study of sacituzumab govitecan versus chemotherapy in patients with metastatic triple-negative breast cancer[J]. Ann Oncol, 2021, 32(9): 1148-1156.
[43]HE Y, JIANG Z H, CHEN C, et al. Classification of triple-negative breast cancers based on immunogenomic profiling[J]. J Exp Clin Cancer Res, 2018, 37(1): 327.
[44]CONROY M, NAIDOO J. Immune-related adverse events and the balancing act of immunotherapy[J]. Nat Commun, 2022, 13(1): 392.
[45]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer risk reduction (version 1. 2022)[J]. (2022-01-31)[2023-03-29]. https://www.nccn.org/.
[46]CANCER GENOME ATLAS NETWORK. Comprehensive molecular portraits of human breast tumours[J]. Nature, 2012, 490(7418): 61-70.
[47]NAKADA T, MASUDA T, NAITO H, et al. Novel antibody drug conjugates containing exatecan derivative-based cytotoxic payloads[J]. Bioorg Med Chem Lett, 2016, 26(6): 1542-1545.
[48]MODI, PARK H, MURTHY R K, et al. Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results from a phase Ⅰb study[J]. J Clin Oncol, 2020, 38(17): 1887-1896.
[49]DIÉRAS V, DELUCHE E, LUSQUE A, et al. Trastuzumab deruxtecan (T-DXd) for advanced breast cancer patients (ABC), regardless HER2 status: a phase Ⅱ study with biomarkers analysis (DAISY)[C]. SABCS, 2021: Abs PD8-02.
[50]MODI S N, JACOT W, YAMASHITA T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer[J]. N Engl J Med, 2022, 387(1): 9-20.
[51]CARDILLO T M, GOVINDAN S V, SHARKEY R M, et al. Sacituzumab govitecan (IMMU-132), an anti-trop-2/SN-38 antibody-drug conjugate: characterization and efficacy in pancreatic, gastric, and other cancers[J]. Bioconjug Chem, 2015, 26(5): 919-931.
[52]BARDIA A, HURVITZ S A, RUGO H S, et al. A plain language summary of the ASCENT study: sacituzumab govitecan for metastatic triple-negative breast cancer[J]. Future Oncol, 2021, 17(30): 3911-3924.
[53]SHARKEY R M, MCBRIDE W J, CARDILLO T M, et al. Enhanced delivery of SN-38 to human tumor xenografts with an anti-trop-2-SN-38 antibody conjugate (sacituzumab govitecan)[J]. Clin Cancer Res, 2015, 21(22): 5131-5138.
[54]BARDIA A, TOLANEY S M, LOIRAT D, et al. Sacituzumab govitecan (SG) versus treatment of physician’s choice (TPC) in patients (pts) with previously treated, metastatic triple-negative breast cancer (mTNBC): final results from the phase 3 ASCENT study[J]. J Clin Oncol, 2022, 40(16_suppl): 1071.
[55]LÜFTNER D, FASCHING P A, HAIDINGER R, et al. ABC6 consensus: assessment by a group of German experts[J]. Breast Care (Basel), 2022, 17(1): 90-100.
[56]KALINSKY K, OLIVEIRA M, TRAINA T A, et al. Outcomes in patients (pts) aged ≥65 years in the phase 3 ASCENT study of sacituzumab govitecan (SG) in metastatic triple-negative breast cancer (mTNBC)[J]. J Clin Oncol, 2021, 39(15_suppl): 1011.
[57]LOIBL S, TOLANEY S M, PUNIE K, et al. Abstract P5-16-01: assessment of health-related quality of life by clinical response from the phase 3 ASCENT study in metastatic triple-negative breast cancer (mTNBC)[J]. Cancer Res, 2022, 82(4_Supplement): P5-16.
[58]KROP I, JURIC D, SHIMIZU T, et al. Abstract GS1-05: Datopotamab deruxtecan in advanced/metastatic HER2- breast cancer: results from the phase 1 TROPION-PanTumor01 study[J]. Cancer Res, 2022, 82(4_Supplement): GS1-5.
[59]WANG J Y, LIU Y J, ZHANG Q Y, et al. RC48-ADC, a HER2-targeting antibody-drug conjugate, in patients with HER2-positive and HER2-low expressing advanced or metastatic breast cancer: a pooled analysis of two studies[J]. J Clin Oncol, 2021, 39(15_suppl): 1022.
[60]BARDIA A, HURVITZ S A, TOLANEY S M, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer[J]. N Engl J Med, 2021, 384(16): 1529-1541.
[61]MODI S N, PARK H, MURTHY R K, et al. Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results from a phase Ⅰb study[J]. J Clin Oncol, 2020, 38(17): 1887-1896.
[62]DIÉRAS V, DELUCHE E, LUSQUE A, et al. Abstract PD8-02: Trastuzumab deruxtecan (T-DXd) for advanced breast cancer patients (ABC), regardless HER2 status: a phase Ⅱ study with biomarkers analysis (DAISY)[J]. Cancer Res, 2022, 82(4_Supplement): PD8-2.
作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言