Nat Commun:c-Myc激活泛癌表达的lncRNA MILIP失活p53并诱导癌症的发生
2020-10-16 xiaozeng MedSci原创
MYC作为特征最明确的原癌基因,在约40%的人类癌症中,染色体易位、基因扩增和上游致癌信号均能够异常激活MYC基因。其产物c-Myc是一种转录因子,可调节涉及多种细胞功能(包括细胞存活和增殖)在内的数
MYC作为特征最明确的原癌基因,在约40%的人类癌症中,染色体易位、基因扩增和上游致癌信号均能够异常激活MYC基因。其产物c-Myc是一种转录因子,可调节涉及多种细胞功能(包括细胞存活和增殖)在内的数千个基因。
既往研究显示,原癌蛋白c-Myc和肿瘤抑制因子p53在调控正常细胞存活和增殖中是一种“阴和阳”的密不可分的关系,它们的这种功能也维持组织的稳态:c-Myc能够诱导ARF肿瘤抑制因子的表达,随后结合并抑制MDM2的表达,最终引起p53的激活;而p53能够通过包括转录失活和microRNA介导的抑制作用在内的多种机制来对c-Myc起抑制作用。然而,在癌细胞中并不存在c-Myc和p53之间的相互调节作用,而这一点也可以由野生型p53中c-Myc的表达失衡可以看出。
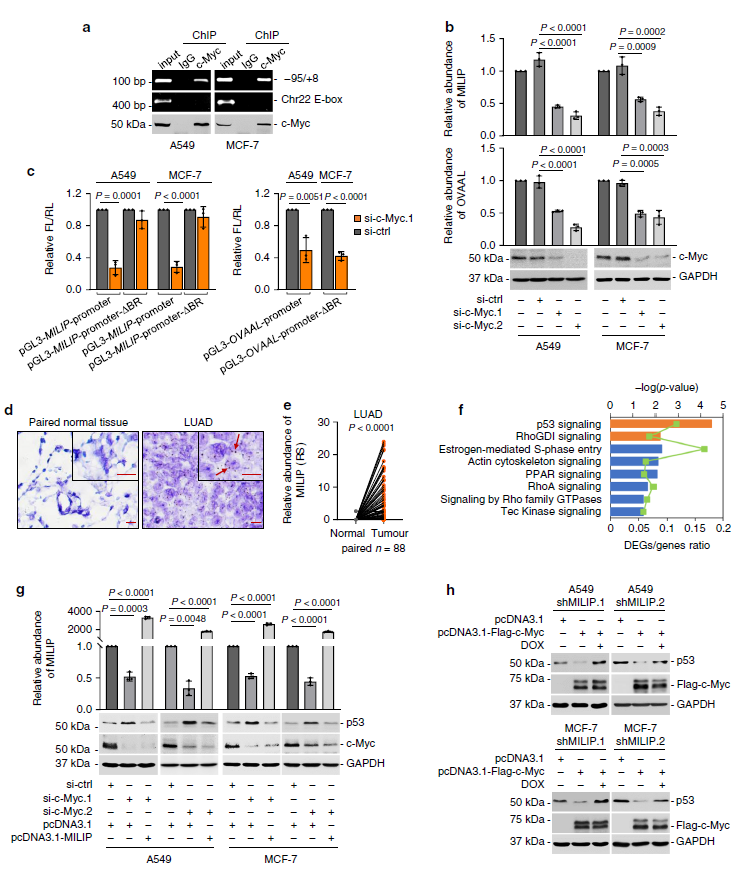
c-Myc激活泛癌lncRNA MILIP抑制p53
尽管癌细胞中p53的抑制通常与ARF的缺失相关,研究人员发现了另一种机制,c-Myc能够通过c-Myc诱导型长非编码RNA失活P53(lncRNA MILIP)这一作用来失活p53。MILIP能够通过抑制TRIML2的表达来降低p53的类泛素化修饰,从而促进p53的多聚泛素化和转化。在多种癌症类型中均能观察到MILIP的表达上调,且发现其对细胞的存活、分裂和致瘤性具有贡献。
MILIP促进癌症的发生
综上,该研究结果揭示了c-Myc与p53抑制的相关机制,即通过泛癌表达的lncRNA靶向抑制p53这一信号通路。
原始出处:
Feng, Y.C., Liu, X.Y., Teng, L. et al. c-Myc inactivation of p53 through the pan-cancer lncRNA MILIP drives cancer pathogenesis. Nat Commun 11, 4980 (05 October 2020).
作者:xiaozeng
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#COMMUN#
111
#Nat#
55
#CRN#
72
#MYC#
67
#lncRNA#
87