Cell:癌症治疗新途径 靶向保护及滋养癌细胞的Skp2蛋白
2013-08-05 koo bio360
2012年,德州大学 MD 安德森癌症中心的科学家们证实,一种名为 Skp2 蛋白发挥了双重的促癌作用:关闭了对抗癌症的一种细胞防御,同时开启了一条癌症摄食代谢信号通路。现在他们找到了一种方法来关闭它。在发表于8月1日《细胞》(Cell)杂志上的新研究论文中,研究人员描述了第一个可直接结合和阻断 Skp2 的化合物,从而开辟了一条潜在的癌症治疗新途径。 论文的共同资深作者、MD 安德森癌症中
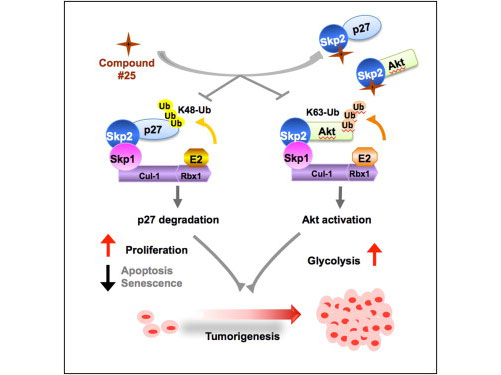
2012年,德州大学 MD 安德森癌症中心的科学家们证实,一种名为 Skp2 蛋白发挥了双重的促癌作用:关闭了对抗癌症的一种细胞防御,同时开启了一条癌症摄食代谢信号通路。现在他们找到了一种方法来关闭它。在发表于8月1日《细胞》(Cell)杂志上的新研究论文中,研究人员描述了第一个可直接结合和阻断 Skp2 的化合物,从而开辟了一条潜在的癌症治疗新途径。
论文的共同资深作者、MD 安德森癌症中心细胞与分子肿瘤学副教授 Hui-Kuan Lin 博士说:“这项研究的亮点在于,我们发现了一种抑制剂,并揭示了它是如何发挥功能阻断 Skp2 的。而人们发现抑制剂通常最初都不了解它们的作用机制。”
Hui-Kuan Lin 和文章的共同资深作者、 MD 安德森癌症中心整合分子发现实验室主任、实验治疗学助理教授张树兴(Shuxing Zhang,音译)展开合作,鉴别并确定了该药物的特征。
张树兴说:“可得到的化合物多过于宇宙中的繁星。我们有一个包含1000万个化合物的数据库,通过初筛分析将我们的计算机搜索缩小至12万个化合物范围,随后进一步找到了 Skp2 的候选小分子抑制剂。”
Hui-Kuan Lin 说,他们的抑制剂插入到 Skp2 上的关键结合位点,阻止了它结合 Skp1 形成复合物,这是 Skp2 发挥双重促癌作用的第一步。
复合物攻击前列腺及肺肿瘤
Hui-Kuan Lin 说:“这一化合物具有高度的特异性。我们在前列腺癌和肺癌中进行测试,证实它优先靶向了癌细胞而非正常细胞。不过在它进入到人类临床试验之前,仍需确定该药物的潜在脱靶效应。”
研究人员还发现,该抑制剂抑制了在癌症发生、进展和化疗耐药中发挥作用的前列腺癌症干细胞。
正常情况下, Skp2 E3连接酶结合并用泛素分子标记其他的蛋白质,激活信号通路或是介导蛋白质降解。 Skp2 在很多的癌症中过量表达,推动了癌症进程和转移。
在以往的研究中, Hui-Kuan Lin 和同事们证实: Skp2 是通过标记破坏可导致细胞衰老或无法进行细胞分裂的抑癌蛋白p27,以及启动一条信号通路来激活癌细胞主要赖以生长和生存的葡萄糖代谢(糖酵解),从而发挥促癌作用。
他们还证实,这一糖酵解信号有助于赫赛汀耐药,以及肿瘤大量表达HER2蛋白的乳腺癌患者生存期缩短。
结构分析确定脆弱点
通过分析 Skp2 与 Skp1 的连接,张树兴研究小组确定了 Skp2 上的两个口袋样区域是它们的结合点。
张树兴说, Skp2 一直被视作是癌症治疗的合理靶点,但靶向它存在有两个主要的障碍。首先靶向蛋白质间的相互作用非常困难,此外, Skp2 是通过一个极大的区域与其他蛋白质发生互作,使得很难找到一种小分子完全阻断该区域。
张树兴说:“要着手开展这样的搜索工作,合理设计出一种药物,你必须首先了解这一靶点的生物学,然后观察它的结构,完全了解它的复杂相互作用,以及如何破坏这些相互作用将有助于治疗疾病。一旦你了解了这些,你就为使用计算机模型进行筛查做好了准备。”
采用张树兴开发的一种程序对12万种化合物进行虚拟筛选,研究人员发现了25种可结合1个或2个口袋的候选化合物。进一步的分析证实#25化合物(又称作SZL-P1-41)能够有效地破坏 Skp1 - Skp2 之间的相互作用。
随后的实验证实,#25 化合物抑制了 Skp2 标记及破坏细胞休眠蛋白p27,在前列腺癌细胞中恢复了p27的表达,并且抑制了激活癌症摄食糖酵解信号通路的 Skp2 信号。
详细的实验表明,药物是通过特异地结合 Skp2 上的一个口袋,破坏 Skp2 - Skp1 复合物形成来发挥效应的。
抑制剂可杀死多种癌细胞
初期细胞系实验表明,#25化合物选择性地破坏了前列腺癌细胞,对正常组织影响极小。研究人员还在两种肺癌细胞系以及肝癌和骨癌细胞系证实了这一药物的效应。
研究证实,该药物作用于前列腺癌细胞的潜在机制是启动了细胞衰老,并抑制了糖酵解。
近期的研究表明,糖酵解对于癌症干细胞形成至关重要,通过缩短端粒诱导细胞老化可抑制癌症干细胞生长。由于#25化合物可以阻断糖酵解并促进细胞衰老,研究小组测试了它对于前列腺癌症干细胞的影响。
治疗完全阻碍了癌症干细胞形成,导致了肿瘤缩小。
用该化合物治疗前列腺癌细胞以一种剂量依赖性的方式减少了癌症干细胞群。而对于 Skp2 沉默的癌细胞该药物则完全没有作用。
由于癌症干细胞是化疗耐药的主要原因,研究人员用#25化合物结合化疗药物多柔比星(doxorubicin)或环磷酰胺(cyclophosphamide)处理细胞系。发现新药将多柔比星抑制癌细胞生长的效应提高了3倍,将环磷酰胺的效应提高了2倍。
逃避细胞衰老,促进糖酵解是癌症进展和耐药的标志。研究小组在前列腺癌和肺癌小鼠中测试了该药物。在两种情况下,相比于注射对照药物的小鼠的肿瘤,治疗小鼠的肿瘤体积只有四分之一大小。
Hui-Kuan Lin 、张树兴和同事们已经为这项研究工作申请了专利保护。
Chia-Hsin Chan, John Kenneth Morrow, Chien-Feng Li, Yuan Gao, Guoxiang Jin, Asad Moten, Loren J. Stagg, John E. Ladbury, Zhen Cai, Dazhi Xu, Christopher J. Logothetis, Mien-Chie Hung, Shuxing Zhang, Hui-Kuan Lin. Pharmacological Inactivation of Skp2 SCF Ubiquitin Ligase Restricts Cancer Stem Cell Traits and Cancer Progression. Cell, 1 August 2013; DOI: 10.1016/j.cell.2013.06.048
作者:koo
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#CEL#
38
#Cell#
34
#癌症治疗#
31
#治疗新途径#
0
#新途径#
43