靶向Aβ的阿尔茨海默症新药BAN2401,开始III期临床研究
2020-07-15 MedSci原创 MedSci原创
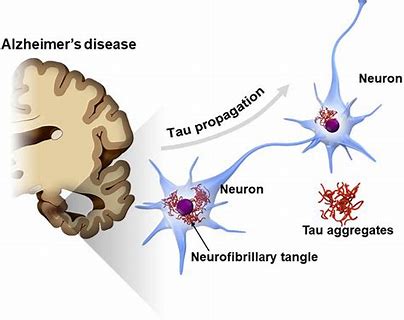
BAN2401是抗淀粉样蛋白(Aβ)的抗体,旨在选择性结合后中和并清除有毒的Aβ蛋白。
Biogen和Eisai宣布开始BAN2401治疗阿尔茨海默氏症(AD)的3期临床研究。BAN2401是一种抗淀粉样蛋白(Aβ)的抗体,旨在选择性结合后中和并清除有毒的Aβ蛋白,而Aβ被认为是引起AD的因素之一。

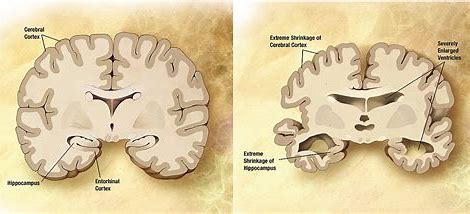
AHEAD 3-45计划分为A3和A45两项试验,旨在评估BAN2401减少大脑中有害的Aβ蓄积和认知能力下降的潜力。A3试验将招募大脑中Aβ含量中等且对Aβ积累有更高风险的参与者,A45试验将招募大脑中淀粉样蛋白水平升高的参与者。
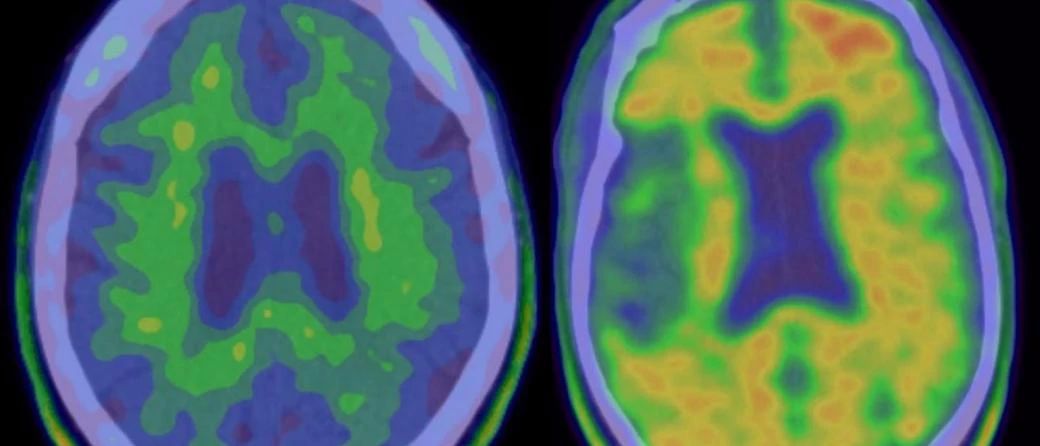
3期临床研究的计划是在2期临床试验取得可喜的成果之后,2期研究结果显示大剂量的BAN2401显着减慢了认知能力下降,并且在18个月的时间点大脑中的Aβ沉积减少。
但是,服用低剂量BAN2401的患者似乎比服用安慰剂的患者认知能力下降更快。尽管合作伙伴公司强调,该现象可能是由于具有快速发展、遗传易感性患者入组引起的不平衡所致,但是在临床终点上缺乏明确的剂量反应使人们对该药物的疗效产生怀疑。
原始出处:
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#I期临床#
40
#BAN2401#
47
#阿尔茨#
35
#阿尔茨海#
40
#III#
35