Moderna递交Omicron特异性mRNA疫苗mRNA-1273.222紧急使用授权申请
2022-08-25 MedSci原创 MedSci原创
2022年8月22日,辉瑞/BioNTech向FDA和EMA递交二价Omicron特异性mRNA疫苗上市申请后(见:辉瑞/BioNTech向FDA和EMA提交二价奥密克戎特异性mRNA疫苗上市申请),
2022年8月22日,辉瑞/BioNTech向FDA和EMA递交二价Omicron特异性mRNA疫苗上市申请后(见:辉瑞/BioNTech向FDA和EMA提交二价奥密克戎特异性mRNA疫苗上市申请),本周Moderna也递交紧急使用授权申请。

2022年8月23日,Moderna宣布已经向FDA递交Omicron变异株特异性mRNA疫苗mRNA-1273.222的紧急使用授权(EUA)申请。

mRNA1273.222的成本为25ug mRNA-1273和25ug的Omicron BA.4/5特异性的mRNA。

2022年7月,莫德纳(Moderna)公布了二价新冠候选疫苗mRNA-1273.214加强针的最新临床数据,效果良好。但是,mRNA-1273.214中的奥密克戎针对的是BA.1,让人怀疑这款疫苗对BA.4/5的作用。虽然数据显示良好(见:莫德纳第二代mRNA新冠疫苗mRNA-1273.214,对BA.4/5效果良好,中和抗体平均滴度达到941)。
本次申请的是mRNA-1273.222,针对BA.4/5开发的,针对BA.4/5的特异性更强,预期较mRNA-1273.214效果更佳。
同时,Omicron BA.4/BA.5为目前美国流行的主要变异株,比例超过90%。
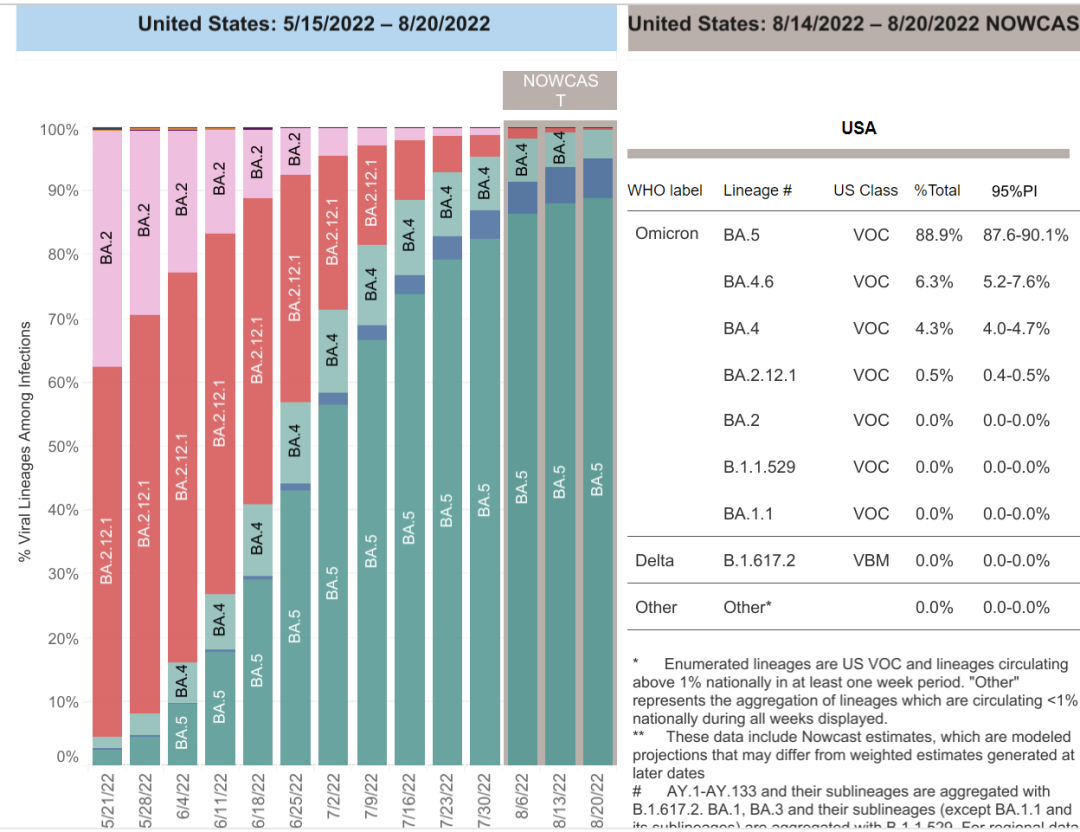
不仅如此,目前预期接下来的流行株可能是BA.4.6或BA.2.75,虽然免疫逃逸能力都超强,但是整体与BA.4/5都有较高的同源性,疫苗仍然具有较好的作用。
辉瑞/BioNtech、Moderna的竞争焦点已经转移到Omicron变异株,几乎同时递交了Omicron BA.4/5变异株特异性mRNA疫苗的上市申请。国内方面,新冠疫苗的竞争同样转移到Omicron变异株,国药中生、石药集团、艾博生物、斯微生物等已经纷纷进入临床阶段。
但是,虽然是Omicron变异株,BA.2以后与BA.1有较大的区别,国内一些疫苗仍然是针对BA.1亚株开发的,与mRNA-1273.214较为类似。因此,需要针对BA.2或BA.4/5开发的疫苗,可能才具有更好的效果。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#特异性#
203
#RNA疫苗#
113
#eRNA#
102
#mRNA-1273#
110
#CRO#
83