金属蛋白酶(MP)是一个在其活性中心具有金属离子的大型蛋白酶家族。根据结构域的不同,金属蛋白酶可分为多种亚型,主要包括基质金属蛋白酶(MMPs)、解整合素金属蛋白酶(ADAMs)以及具有血栓反应蛋白基序的ADAMs(ADAMTS)。它们具有蛋白质水解、细胞粘附和细胞外基质重塑等多种功能。
金属蛋白酶在多种类型的癌症中表达,并通过调节信号转导和肿瘤微环境参与涉及肿瘤发生、发展、侵袭和转移的许多病理过程。因此,更好地了解MP在癌症免疫调节中的表达模式和功能将有助于开发更有效的癌症诊断和免疫治疗方法。
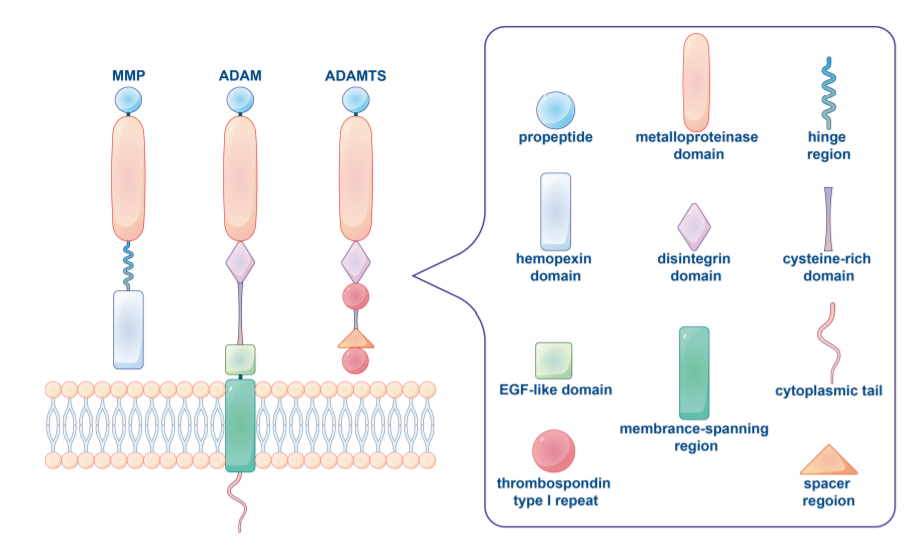
基质金属蛋白酶(MMP)
在脊椎动物中,MMP家族由28个成员组成,至少23个在人体组织中表达,其中14个在脉管系统中表达。基质金属蛋白酶通常根据其底物和其结构域的组织结构分为胶原酶(MMP1、MMP8、MMP13)、明胶酶(MMP2、MMP9)、溶血素(MMP3、MMP10、MMP11)、基质溶素(MMP7、MMP26)、膜型MMPs(MT MMPs)或其他MMPs。MMP家族有一个共同的核心结构。典型的MMPs由大约80个氨基酸的前肽、170个氨基酸的金属蛋白酶催化结构域、可变长度的连接肽或铰链区和约200个氨基酸的血红素蛋白结构域组成。
不同类型的MMP具有不同于典型MMP的特定结构特征。例如,MT MMPs缺乏前结构域,而MMP7、MMP26和MMP23缺乏Hpx结构域和连接肽。此外,MMP2和MMP9包含纤连蛋白的三个重复。MMPs中的这些不同结构域、模块和基序参与与其他分子的相互作用,从而影响或决定MMP活性、底物特异性、细胞和组织定位。
MMPs已在多种人类癌症中检测到,MMPs的高表达通常与大多数癌症的生存率降低有关,包括结直肠癌、肺癌、乳腺癌、卵巢癌和胃癌。其中MMP2和MMP9,能够降解基底膜中的IV型胶原,是研究最广泛的金属蛋白酶,与各种癌症患者的疾病进展和生存率降低相关。
解整合素金属蛋白酶(ADAM)
ADAMs是锚定在细胞表面膜上的I型跨膜蛋白,迄今已发现30多种。与MMPs类似,ADAMs包括前结构域和锌结合金属蛋白酶结构域。ADAM还包括一个在细胞表面蛋白中独特的去整合素结构域。ADAM的金属蛋白酶结构域高度保守,大多数ADAM都有一个富含半胱氨酸的结构域和跨膜区域相邻的EGF样结构域,然后是一个长度和序列在不同ADAM家族成员之间变化很大的胞内区。由于这些结构域的存在,ADAM可以结合底物并影响细胞粘附和迁移的变化,以及细胞表面分子的蛋白水解释放。它们的主要底物是完整的跨膜蛋白,如生长因子、粘附分子和细胞因子的前体形式。
癌细胞通常表达高水平的ADAM,ADAM17是所有ADAM蛋白中研究最广泛的。一项评估ADAM17作为卵巢癌潜在血液生物标志物的研究表明,与对照组相比,培养的卵巢癌细胞系的培养基上清液以及卵巢癌患者的血清和腹水中的ADAM17水平明显更高。
具有血栓反应蛋白基序的ADAM(ADAMTS)
ADAM不同,ADAMTS是一种分泌型金属蛋白酶,其特征在于辅助结构域包含血栓反应蛋白1型重复序列(TSR)和间隔区,并且缺少跨膜区、胞内域和(EGF)样结构域,人ADAMTS家族包括19种蛋白。ADAMTS蛋白酶参与前胶原和von Willebrand因子的成熟,以及与形态发生、血管生成和癌症相关的ECM蛋白水解。
研究表明,不同的ADAMTS具有不同的生物学功能,并且个体ADAMTS可以在不同的癌症中或根据临床环境发挥不同的作用。与MMPs和ADAMs相比,ADAMTS在TME中的参与研究较少,因此迫切需要系统地研究其在癌症中的功能。
信号转导途径由多个分子组成,它们相互识别和相互作用,并传递信号以调节许多重要的生物学过程,如肿瘤细胞增殖、转移和免疫调节。三种信号通路尤其与免疫调节中的MP密切相关。
肿瘤坏死因子信号
肿瘤坏死因子-α(TNF-α)是一种重要的促炎细胞因子,参与免疫系统的维持和稳态,以及炎症和宿主防御。可溶性TNF-α通过蛋白水解酶ADAM17,也称为TNF-a转换酶(TACE),从跨膜TNF-α(tmTNF-α)裂解,该酶可通过激活TNF-α来协调免疫和炎症反应。鉴于ADAM17对TNF信号通路的受体和配体的作用,ADAM17被认为以多种方式影响TNF-α信号传导。例如,可溶性TNF-α产生的减少将导致tmTNF-α的积累,其将与TNFR2结合并导致不同的生物学结果。
转化生长因子–β
转化生长因子-β(TGF-β)作为肿瘤行为的关键调节因子,在肿瘤侵袭和转移、免疫调节和治疗抵抗中发挥重要作用。TGF-β也是TME免疫抑制的核心,根据具体情况对免疫系统具有多效性功能。
MMP9和MMP2是已知的两种金属蛋白酶,可切割未激活的TGF-β前体并产生不同的TGF-β蛋白水解切割产物,从而导致TGF-β活化。此外,与CD44结合的MMP9降解纤连蛋白导致活性TGF-β的释放。癌细胞中MMP9的水平不仅可能影响TGF-β的蛋白水解,还可能影响TGFβ和TGF信号通路下游物质的表达。对乳腺癌中MMP9与TGF信号通路之间关系的研究表明,乳腺癌细胞中MMP9的过表达不仅显著上调了SMAD2、SMAD3和SMAD4的表达,还增强了SMAD2的磷酸化。
Notch信号通路
Notch信号涉及肿瘤生物学的多个方面,其在免疫应答的发展和调节中的作用比较复杂,包括塑造免疫系统和TME的组成部分,例如抗原呈递细胞、T细胞亚群和癌细胞之间的复杂串扰。特别是,Notch在不同免疫细胞的发育和维持中发挥着关键作用。
配体与Notch受体结合后,下游信号由包括ADAM家族成员在内的一些蛋白酶介导。首先,受体/配体相互作用暴露了蛋白水解切割位点S2,其被ADAM金属蛋白酶切割。γ-分泌酶介导的S3处的后续裂解发生在跨膜区,导致Notch胞内结构域(NICD)的释放,该结构域转移到细胞核中,并将MAML与RBPJ结合,触发靶基因如Myc、P21和HES1的转录。已知ADAM10和ADAM17参与裂解S2,而ADAM17导致配体非依赖性Notch激活,ADAM10导致配体依赖性激活。
TME是指肿瘤细胞周围的微环境,包括血管、免疫细胞、成纤维细胞、骨髓源性抑制细胞、各种信号分子和ECM。TME在调节癌症的免疫反应中起着关键作用。
MP对ECM的影响
ECM是TME基质的非细胞成分,ECM的重塑在癌症的发展和体内稳态以及免疫细胞募集和组织转移中起着重要作用。癌症进展过程中ECM的广泛重塑导致其密度和组成发生变化,具体而言,蛋白酶诱导的ECM成分的分解对于肿瘤细胞跨越组织屏障至关重要。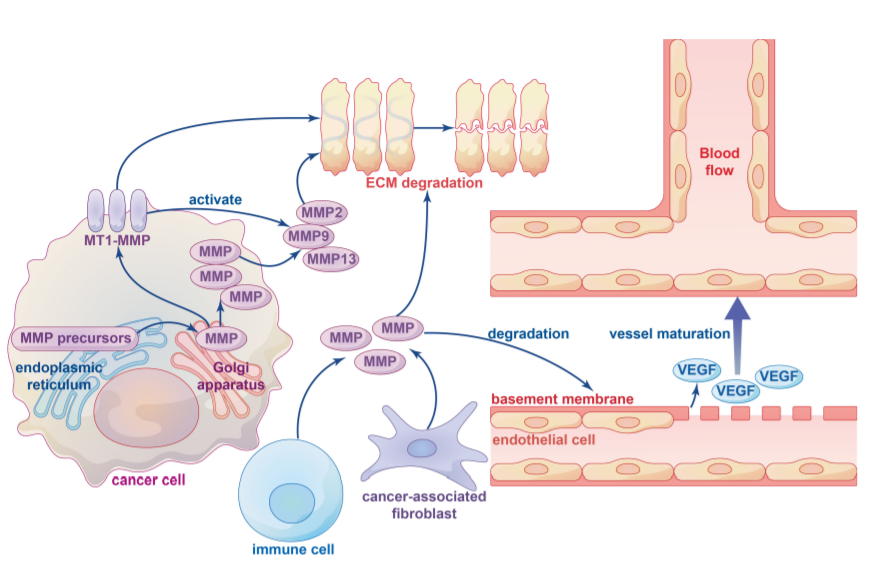
MMPs和ADAMs是参与ECM降解的主要酶,参与ECM降解的MMPs可大致分为膜锚定MMPs和可溶性MMPs。ECM降解主要通过MT1 MMP激活的可溶性MMP(如MMP2、MMP9和MMP13)实现。ECM有三个主要成分:纤维、蛋白聚糖和多糖。MMPs通过与这些基质结合以促进各种ECM蛋白的周转,在组织重塑中发挥重要作用。MMPs降解ECM的具体机制尚不清楚,需要进一步研究。
MP与免疫细胞之间的关系
MP在促进免疫细胞活性和调节免疫细胞迁移方面发挥重要作用。MP和免疫细胞之间的关系如下图所示。
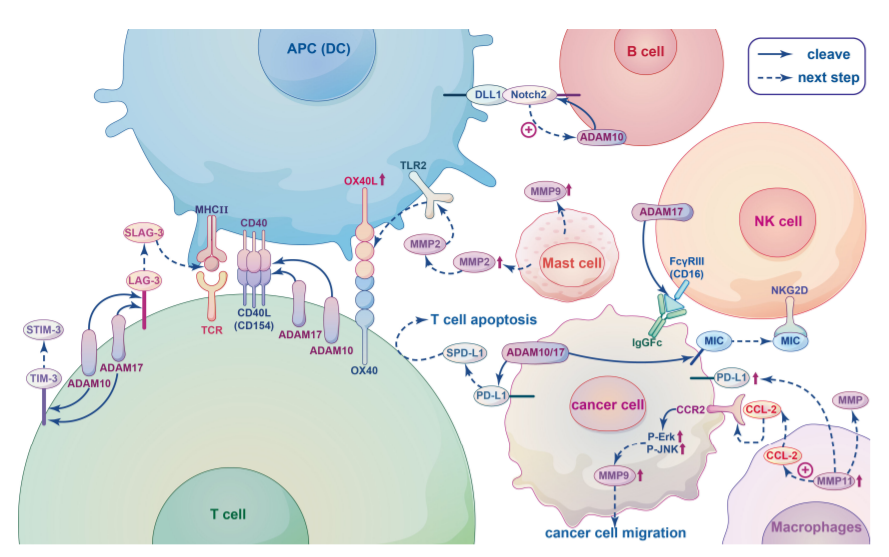
ADAM10和ADAM17在静止的CD4+Th细胞表面表达,对调节CD4+Th的发育和功能很重要。ADAM10/17在T细胞共刺激受体以及共抑制受体的脱落中发挥关键作用。例如,CD154(CD40L)是一种II型膜共刺激受体,在T细胞和APC之间的相互作用后,CD154表达在几个小时内迅速上调,随后在ADAM10和ADAM17裂解后从T细胞表面释放。此外,ADAM10和ADAM17还作用于共刺激受体CD137,以及抑制性受体LAG-3、TIM-3,sLAG-3和sTIM-3的可溶性形式都是在ADAM10和ADAM17蛋白水解裂解后形成的。
B细胞是体液免疫的关键细胞成分,位于脾脏中边缘区B细胞(MZB)表达高水平的CD80/86共刺激分子,导致T细胞活化。Notch2信号传导是MZB细胞发育所必需的,在MZB的发育过程中,Notch2异二聚体与基质细胞和APC上的DLL1等配体结合,这启动了一种未知的金属蛋白酶水解受体,导致Notch胞内结构域的释放,该结构域转移到细胞核并触发下游靶基因的表达。这种未知的金属蛋白酶可能是ADAM10。
NK细胞表达IgG Fc受体FcγRIII(CD16),CD16分子可被ADAM17从活化的NK细胞表面裂解,ADAM17的抑制会削弱CD16和CD62L的胞外脱落,从而显著增加细胞内TNF-α和IFN-γ的水平。此外,MMPs和ADAMS可以从肿瘤细胞表面切割活化受体NKG2D的配体。这些裂解蛋白的可溶性形式与NKG2D结合,并诱导该受体的内吞和降解,导致肿瘤逃避监控。总的来说,ADAM17裂解的多种底物与NK细胞的不同作用有关。
肿瘤相关巨噬细胞(TAM)有助于癌症的发生和恶性进展,高水平的TAM与预后不良和总体生存率降低有关。在多种癌症中,发现TAM通过分泌MMPs促进肿瘤血管生成和侵袭,并调节免疫反应。MMP的调节与TAM分泌的趋化因子密切相关。
与MPs相关的免疫调节细胞因子
多种来源于肿瘤细胞的细胞因子,包括TGF-β、EGF、HGF和TNF-α,介导许多MP的表达。其中最重要的是MMP9,其在血清和与肿瘤相关的组织中升高,并参与ECM的降解,以促进癌症中免疫细胞的迁移。
此外,这些细胞因子必须被MP切割以参与肿瘤免疫过程。例如,被ADAM17切割的TmTNF-α产生活性sTNF-α。IL-12在T细胞发育和扩增中也起着关键作用,未激活的IL-12前体需要在被MMP14切割之后在TME中转变为活性状态。
金属蛋白酶和血管生成
迄今为止,已经报道了几种类型的肿瘤血管生成,包括萌芽血管生成和血管生成拟态(VM)。萌芽血管生成是通过血管基底膜中各种水解酶(如MP和组织纤溶酶)的上调实现的,这导致基底膜和ECM的降解和重塑。例如,在胰腺神经内分泌肿瘤中,MMP9分泌增加会从基质中释放出隔离的VEGF,从而将血管静止转变为活跃的血管生成。在肺癌细胞中,MMP2活性的抑制减少了其与整合素AVB3的相互作用,并抑制了下游PI3K/AKT信号介导的VEGF的表达,导致血管生成减少。
VM是侵袭性肿瘤形成新血管的新模型,为肿瘤生长提供血液供应。研究表明,实体瘤的初始缺氧环境与VM密不可分,缺氧与MMPs的表达和活性密切相关。低氧诱导因子-1α(HIF-1α)已被证明直接调节MMP14、MMP9和MMP2的表达。
鉴于MP在癌症免疫调节中的作用,人们开始探索靶向MP的免疫治疗,临床试验中出现了多种广谱MP抑制剂。然而,由于药物的非特异性靶向和MP在免疫调节中的复杂作用,MP抑制剂迄今未能改善癌症患者的生存和预后。最近,有报道称MP抑制剂可用于联合治疗,以提高免疫治疗的疗效。
SB-3CT作为一种MMP2/9抑制剂,被认为可以提高抗PD-1和抗CTLA-4治疗黑色素瘤和肺癌小鼠模型的疗效。SB-3CT治疗不仅通过减少多种致癌途径导致PD-L1表达减少,而且与抗PD-1治疗相结合,显著改善了免疫细胞浸润和T细胞的细胞毒性。此外,SB-3CT与抗CTLA-4的组合增强了PD-L1表达的下调,并增加了肿瘤中活化的肿瘤浸润CD8+T细胞的丰度。
Andecaliximab(GS-5745)是一种选择性抑制MMP9的单克隆抗体,GS-5745通过与MMP9前体结合并阻止MMP9活化来抑制MMP9,而与活性MMP9的结合则抑制其活性。Fab 3369作用于MMP14,阻断细胞表面表达的内源性MMP14,并抑制三阴性乳腺癌(TNBC)中ECM的降解。此外,有多种抗体可有效抑制ADAM17,包括A12、A9和MED13622。还有一些小分子抑制剂在临床开发中,在临床试验中显示出积极的效果。
MP在TME中的免疫调节中发挥重要作用,包括ECM重塑、信号通路转导、细胞因子脱落和释放以及促进血管生成。与MP相关的新兴技术和药物在癌症诊断和治疗中得到了越来越多的探索。因此,更好地了解MP在癌症免疫调节中的表达模式和功能将有助于开发更有效的癌症诊断和免疫治疗方法。基于MP的探索和新技术具有巨大潜力,它们可能会为未来的癌症诊断和治疗提供有效的策略。
参考文献:
1.Immunomodulatory role of metalloproteases in cancers: Current progress and future trends. Front Immunol.2022; 13: 1064033.
作者:小药说药
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言