PD-L1单抗Bavencio,获得FDA批准用于晚期或转移性尿路上皮癌患者的维持治疗
2020-07-01 MedSci原创 MedSci原创
Bavencio作为一线维持治疗将患者的中位总体生存期(OS)提高了7.1个月。
默克和辉瑞宣布,美国食品药品管理局(FDA)已扩展其PD-L1抗体Bavencio(avelumab)的应用范围,用于一线含铂化疗后尚未进展的局部晚期或转移性尿路上皮癌(UC)患者的维持治疗。
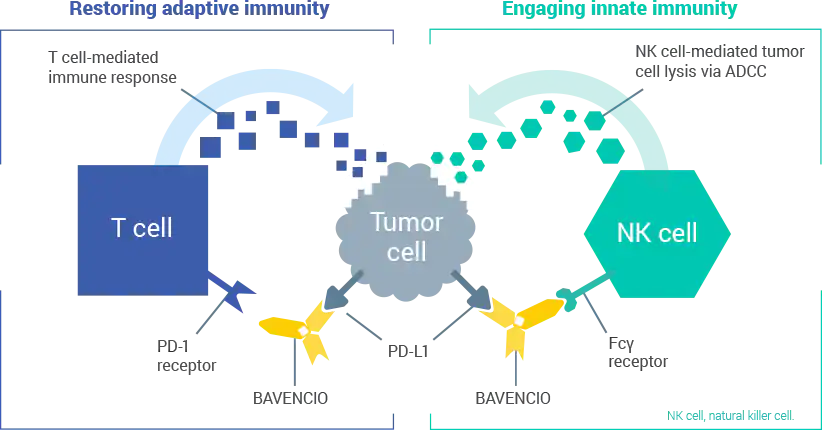
图片来源:https://www.bavencio.com/hcp/moa
此次批准基于III期JAVELIN Bladder 100研究的结果,结果显示,与单独使用最佳支持治疗(BSC)相比,Bavencio作为一线维持治疗联合BSC的中位总体生存期(OS)显着提高了7.1个月,分别为14.3个月和21.4个月。
OS的统计上显着改善,使得整个患者人群的死亡风险降低了31%。
JAVELIN Bladder 100试验的主要研究人员Petros Grivas表示:“作为首个在局部晚期或转移性尿路上皮癌的一线治疗中显示出总体生存率有统计学显着改善的免疫疗法,美国FDA批准avelumab是30年该疾病领域最重要的进展之一。”
基于铂类的化疗目前是高应答率晚期尿路上皮癌患者的一线治疗标准,但是,大多数患者在治疗9个月内疾病进展,只有5%的患者转移前的寿命超过五年。
原始出处:
http://www.pharmatimes.com/news/us_approves_bavencio_for_bladder_cancer_1343377
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#NCI#
56
#FDA批准#
61
#PD-L1#
66
#转移性#
49
#转移性尿路上皮癌#
58