STTT:中山大学庄诗美团队通过抑制蛋白酶体和WEE家族激酶协同诱导有丝分裂焦亡和肿瘤缓解
2024-07-15 iNature iNature
该研究表明BTZ处理或沉默 PSMC5导致G2期和M期停滞、多极纺锤体形成以及随后的 caspase-3/GSDME介导的M期焦亡(指定为有丝分裂焦亡)。
有丝分裂突变(MC)发生在有丝分裂失调的情况下,代表了一种特异性根除肿瘤细胞的迷人策略。细胞焦亡是否是 MC 的死亡形式仍不得而知。蛋白酶体介导的蛋白质降解对 M 期至关重要。抑制蛋白酶体20S催化颗粒的硼替佐米(BTZ)被批准用于治疗多发性骨髓瘤和套细胞淋巴瘤,但由于原发性耐药性,不能治疗实体瘤。迄今为止,蛋白酶体抑制剂是否以及如何影响M期细胞的命运仍未探索。
2024年7月12日,中山大学庄诗美团队在Signal Transduction and Targeted Therapy发表题为“Synergistic induction of mitotic pyroptosis and tumor remission by inhibiting proteasome and WEE family kinases”的研究论文,该研究表明BTZ处理或沉默 PSMC5导致G2期和M期停滞、多极纺锤体形成以及随后的 caspase-3/GSDME介导的M期焦亡(指定为有丝分裂焦亡)。进一步的研究表明,WEE1/PKMYT1(PD0166285)抑制剂,而不是ATR、CHK1 或CHK2抑制剂,可消除BTZ诱导的 G2 期停滞,从而加剧 BTZ 诱导的有丝分裂停滞和细胞焦亡。
BTZ和PD0166285联合治疗(称为BP-Combo)选择性地杀死各种类型的实体瘤细胞,与BTZ或PD0166285单一治疗相比,BTZ和PD0166285的IC50显著降低。使用各种小鼠模型的研究表明,BP-Combo对肿瘤生长和转移的抑制作用比BTZ或PD0166285单一治疗要强得多,并且在BP-Combo治疗的小鼠中没有观察到明显的毒性。这些发现揭示了蛋白酶体抑制剂在诱导M期细胞焦亡中的作用,将细胞焦亡表征为有丝分裂灾难的一种新的死亡形式,并确定蛋白酶体和WEE家族激酶的双重抑制是一种有前途的选择性杀伤实体瘤细胞的抗癌策略。

有丝分裂突变(MC)发生在异常有丝分裂下,通常在有丝分裂失调期间或之后不久导致细胞死亡。它伴随着延长的有丝分裂持续时间,称为有丝分裂停滞。MC可由多种刺激触发,可能使癌细胞更容易发生有丝分裂畸变,因此对MC 比正常细胞更敏感。有丝分裂突变下报道的细胞死亡模式归因于内在细胞凋亡。迄今为止,焦亡(最近定义的程序性坏死细胞死亡)是否与MC有关仍未报道。细胞焦亡由gasdermin家族特异性介导,除DFNB59外,gasdermins共享高度保守的N端和C端结构域,由可变接头隔开。一旦接头被切割,N端结构域与细胞质膜的酸性磷脂结合并形成膜孔,这会破坏渗透电位并导致特征性的形态和生化特征。
在有丝分裂期(M期),两者都转录和翻译的mRNA被全局抑制,因此蛋白酶体介导的蛋白质降解在调节M期中起着重要作用。蛋白酶体由20S催化颗粒(20S-CP)和19S调节颗粒(19S-RP)组成。癌细胞沉迷于增强的蛋白酶体活性,以实现有效的蛋白质周转以支持其存活和增殖,因此可能对蛋白酶体抑制剂的治疗敏感。硼替佐米(BTZ)可逆地与β5亚基结合并抑制蛋白酶体活性,是第一个被批准用于治疗人类血液系统癌症的蛋白酶体抑制剂。然而,对蛋白酶体抑制剂的原发性耐药性仍然是其在实体瘤临床应用的一大挑战。
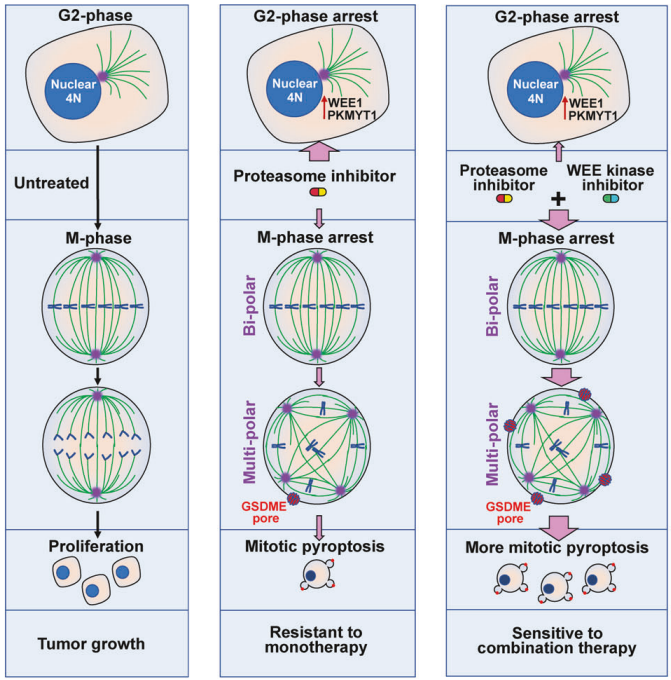
蛋白酶体和WEE激酶抑制剂之间协同相互作用的工作模型(图源自Signal Transduction and Targeted Therapy )
迄今为止,蛋白酶体抑制是否能引起细胞焦亡尚未见报道。BTZ可诱导细胞周期阻滞于G2/M期,其机制可能与增加4N细胞比例有关,但不能区分M期和G2期细胞。蛋白酶体抑制剂是否以及如何影响m期细胞的命运尚不清楚。此外,BTZ引发MC的推测是基于异常核型,而不是通过高通量视频显微镜或延时荧光显微镜分析活细胞的有丝分裂过程,以及有丝分裂标志物与细胞死亡指标的共染色。显然,蛋白酶体抑制剂在m期和MC中的作用有待进一步研究。
G2/M 期阻滞受检查点激酶 1/2(CHK1/2)和WEE家族激酶的调节。不幸的是,CHK1/2 和 WEE 家族激酶抑制剂显示出高级别的血液学毒性和低疗效,导致进一步的临床开发终止。ATR 是 CHK1/2-WEE1 通路的顶端激酶,一些 ATR 抑制剂具有更好的毒性特征。这些激酶抑制剂是否能与蛋白酶体抑制剂协同作用,引发有丝分裂异常、焦亡和MC,或降低药物毒性,目前尚不得而知。
该研究发现BTZ处理或PSMC5沉默对蛋白酶体的抑制导致有丝分裂异常和随后的 M 期 GSDME 介导的焦亡。此外,BTZ和PD0166285联合治疗(称为BP-Combo)在体外选择性杀伤各类实体瘤细胞方面显示出协同作用,并显著降低了BTZ和PD0166285的IC50。一致地,多个体内模型显示BP-Combo可以抑制肿瘤生长和转移,并以低毒性延长荷瘤小鼠的存活期。这些发现揭示了蛋白酶体抑制剂在有丝分裂性焦亡中的调节作用,并确定了蛋白酶体和WEE家族激酶的联合抑制是一种有吸引力的抗癌策略,可以降低药物剂量,具有更好的安全性以及更有效的抗肿瘤功效。
参考消息:
https://doi.org/10.1038/s41392-024-01896-z
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#实体瘤# #蛋白酶体抑制剂# #细胞焦亡# #有丝分裂突变#
91