Nature:挑战常规,绝大多数人肠道细菌能够在体外培养
2016-05-07 佚名 生物谷
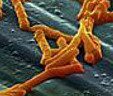
研究人员在论文中写道,“环境中的艰难梭菌孢子在释放后长时间内具有高度传染性,通常在局部进行传播,但也能够潜在地快速扩散到较远的地方。”图片来自Wikimedia/Cjc2nd。 微生物几乎在地球每个环境中蓬勃生长,但是令人吃惊的是,已知当在实验室中培养时,只有一小部分能够茁壮成长。因此,研究人肠道微生物组主要采用基因组方法。如今,在一项新的研究中,通过将微生物培养实验和基因组方法结合在一起,来自
研究人员在论文中写道,“环境中的艰难梭菌孢子在释放后长时间内具有高度传染性,通常在局部进行传播,但也能够潜在地快速扩散到较远的地方。”
微生物几乎在地球每个环境中蓬勃生长,但是令人吃惊的是,已知当在实验室中培养时,只有一小部分能够茁壮成长。因此,研究人肠道微生物组主要采用基因组方法。如今,在一项新的研究中,通过将微生物培养实验和基因组方法结合在一起,来自英国韦尔科姆基金会桑格学院研究所(Wellcome Trust Sanger Institute)等机构的研究人员及其同事证实与广泛接受的观念---大多数微生物在体外是“不能培养的(unculturable)”---相反的是,大多数已知的肠道微生物物种能够在体外培养和保存。这些研究结果揭示出很多之前“不能培养的”肠道微生物属于新的群体,而且为了在人体外存活下来,它们当中将近60%形成孢子。相关研究结果于2016年5月4日在线发表在Nature期刊上,论文标题为“Culturing of ‘unculturable’ human microbiota reveals novel taxa and extensive sporulation”。
美国北卡莱罗纳大学微生物学教授James Oliver(未参与这项研究)说道,“这真地是一项非常完美的研究,它面面俱到,作出重要贡献。”
为了评估多少人肠道菌群在体外能够培养,来自韦尔科姆基金会桑格学院研究所的Trevor Lawley和同事们开始利用来自6名健康人的新鲜粪便样品开展研究。他们对这些样品进行测序以便从中鉴定出细菌多样性,在含有YCFA培养基的培养皿上培养来自这些样品的细菌,然后对原始样品的基因组测序数据与能够在培养皿中生长的细菌菌种的基因组测序数据进行比较。他们报道,这些基因组序列的72%在这两者之间是相同的,而且来自这些在体外可培养的细菌菌落的基因组序列代表着一种更加大型的涉及318人肠道微生物组的数据集中存在的全部基因的39%。不过,研究人员发现为了匹配通过对粪便样品直接测序可能达到的菌种检测水平,在培养皿上能够培养800万个细菌菌落。
Oliver认为,这些方法能够应用于其他的自然环境中,如海洋和土壤。他说,“人们总是利用分子方法开展研究,这是因为体外培养方法只能培养[这些环境中的]一小部分微生物。”
总体上,研究人员分离出137种截然不同的细菌种类,它们当中的90%位于人类微生物组项目(Human Microbiome Project)中“最想要的”但之前不能在体外培养的也没有测序过的微生物清单中。研究人员分离和保存的这些细菌菌落一起代表着在这6名研究参与者体内鉴定出的细菌群体的90%。Lawley说,“在此之前,人们的一般观点是只能培养这些菌群中的1~5%。但是,我们声称实际上能够培养它们当中的绝大多数。”
基于提示着肠道微生物群落中的很多菌种为了在人体外生存而形成孢子的基因组数据,Lawley团队杀死活的细菌,结果发现几种菌种---共生菌和致病菌---通过形成孢子存活下来。这些孢子只在人胆酸存在时才能萌发,这提示着肠道细菌在不同人之间传播时依赖孢子形成存活下来,而且依赖作为“定植信号(colonization cue)”的胆酸在肠道内生长。研究人员估计,这些形成孢子的菌种代表着肠道总菌群的30%。
Lawley说,之前对人肠道微生物组的研究“主要基于测序。” Lawley认为,这项突破确实允许他们继续开展功能性研究,和验证之前基于基因组序列的研究结果。
Oliver注意到,这些结果将允许在实验室对多种肠道微生物的功能和相互作用进行代表性地研究。他补充道,描述特定的细菌菌种的作用可能有助改善诸如治疗艰难梭菌(Clostridium difficile)感染和其他疾病的粪便菌群移植之类的疗法。
美国东北大学微生物学家Slava Epstein(未参与这项研究)说,总而言之,这些发现是“非常令人关注的和潜在重要的”,“它挑战了目前正在采用的微生物培养方法,同时提供大量希望---当然,前体是这项研究报道的成功在进一步的研究中能够再现
原始出处:
Hilary P. Browne, Samuel C. Forster, Blessing O. Anonye, Nitin Kumar, B. Anne Neville, Mark D. Stares, David Goulding & Trevor D. Lawley.Culturing of ‘unculturable’ human microbiota reveals novel taxa and extensive sporulation.Nature.doi:10.1038/nature17645
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
33
#体外培养#
34
行走的大便
164
大便胶囊,新药品
113
#肠道细菌#
24