Psychiatry Research:选择性血清素再摄取抑制剂的使用是否会影响与年龄相关的神经病理学和晚年认知?
2023-09-19 xiongjy MedSci原创
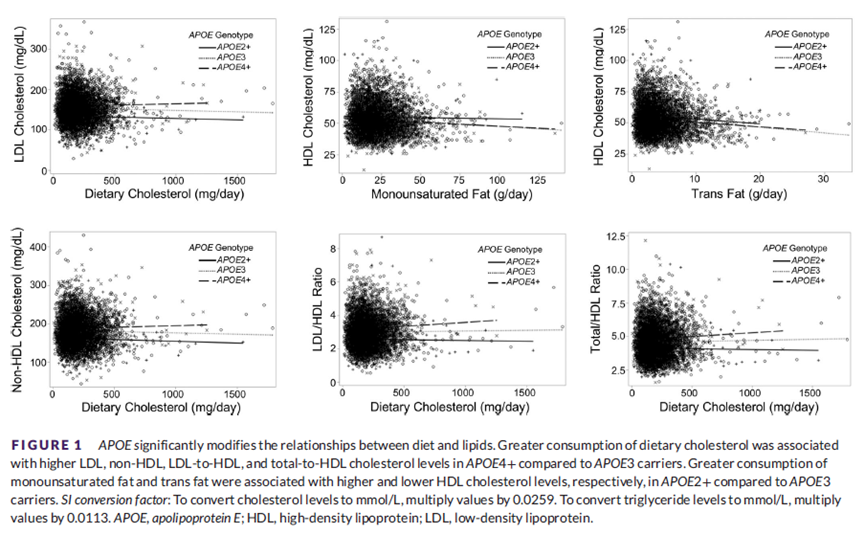
本研究中的病理模型反映了死前几十年大脑中累积的神经退行性变化及其对渐进性认知衰退的影响。本文结果表明,认知变化与 tau 而非 SSRI 有关。
超过4,300万美国人服用抗抑郁药,其中70%以上使用选择性5-羟色胺再摄取抑制剂(SSRIs),最近老年人使用SSRIs的人数有所增加。令人担忧的是,在最近的纵向研究中,SSRI 的使用与更快的认知能力下降和更高的痴呆风险有关。
为什么SSRIs可能与晚年认知能力下降有关?晚年认知能力下降的大部分原因是常见的与年龄相关的神经退行性病变和脑血管病变, 这些过程可能会导致神经递质水平的变化,而神经递质水平的变化与晚年情绪症状的变化有关,因此处方 SSRI 可减轻这些病理相关症状。

本研究探讨了常见痴呆症相关病理在 SSRIs 与认知能力下降之间的关系。作为两项统一的临床病理学队列研究的一部分,老年人每年都要接受认知功能测试,死亡时还要进行脑部尸检和统一的神经病理学检查,以评估常见的神经退行性病变和脑血管病变。在分析中,我们比较了在随访期间开始服用 SSRI 的患者与从未服用过 SSRI 的患者的认知功能下降率。在死亡并接受神经病理学检查的人群中,我们确定了服用SSRI与死后病理标志物之间的关联,并检验了这些关联部分解释了服用SSRI与认知能力下降之间关联的假设。
为了防止研究出现偏差,为每位使用过 SSRI 的参与者匹配了一位年龄和教育程度相同的非 SSRI 参与者,在配对时也对样本进行了正常认知、MCI或痴呆症诊断的配对。作者创建了一个新的分析基线,以防止与时间相关的偏差。
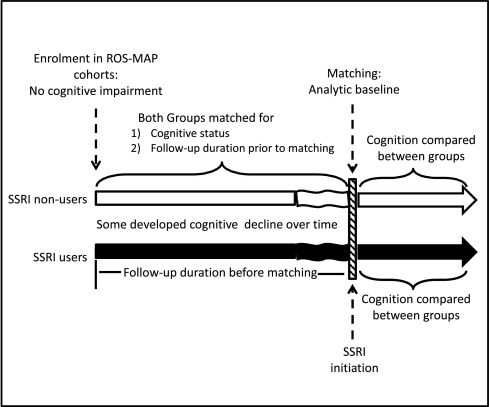
Figure. 1. Study design
从这一分析基线开始,对这些参与者的认知情况进行跟踪。由于部分 SSRI 使用者的随访时间不足以进行纵向分析,因此在配对过程中产生了 374 名使用者和 736 名从未使用过 SSRI 的使用者。从加入 ROS-MAP 组群到最后一次临床评估的随访时间中位数(Q1-Q3)为 10.05(8.2)年。从加入队列到匹配样本(分析基线)的中位数(Q1-Q3)时间为 5.3(6.2)年。从分析基线到最后一次评估的随访时间中位数(Q-Q3)为 3(5.7)年。
可以注意到,在参与者开始服用 SSRI 后,平均每年有 70% 的就诊者(SD 31,中位数 80%,Q1-Q3 50)服用了这些药物。一旦开始服用 SSRI,到最后一次临床评估时,SSRI 使用者平均服药 4.4 年(标准差 4.3)。这些数据表明,SSRI 与认知能力的关系与长期用药而非短期用药有关。

年度临床评估在每位受试者的住所进行,评估内容包括病史、神经系统检查和认知测试,还收集了有关是否存在血管疾病负担的数据。血管疾病负担的衡量标准是基于是否有冠心病、中风和跛行病史。还使用了高血压、心肌梗塞、中风、甲状腺疾病、癌症和意识丧失的头部损伤作为协变量。然后,研究者将这一医疗状况变量与人口统计学变量一起作为全局认知主要模型的协变量。此外,本文还为降脂药物和抗高血压药物创建了单独的变量,并在调整了人口统计学因素的核心模型中添加了协变量,进行了两项单独的分析。为常用药物建了一个额外的变量,并在主模型中将这些变量与人口统计学变量一起单独使用。卡茨指数通过卡茨日常生活活动量表测量六种基本身体能力:走过小房间、洗澡、穿衣、吃饭、从床上到椅子上以及如厕。在每次年度评估时进行 19 项认知功能测试,包括七项外显记忆测试、三项语义记忆测试、三项工作记忆测试、四项感知速度测试和两项视觉空间能力测试。为了在纵向分析中尽量减少下限和上限伪影以及其他形式的测量误差,作者采用了一种基于所有 19 项测试的全局认知综合测量方法。年度临床评估包括病史、神经系统检查和认知测试。认知功能测试用于评定定向力、注意力、记忆力、语言和感知等领域的损伤程度。每次评估时,参与者都要填写一份由 10 个项目组成的流行病学研究中心抑郁量表。
神经病理学检查采用了以下病理指标:β-淀粉样蛋白、成对螺旋丝状的陶氏丝(PHF)、路易体病、血管病变(严重梗塞或微小梗塞、中重度动脉粥样硬化、动脉硬化和脑淀粉样血管病)、海马硬化和跨活性反应 DNA 结合蛋白 43(TDP-43)。
为了进行统计分析,作者选择了SSRI使用者和从未使用者的匹配样本。简而言之,确定了每件使用者的基线年龄、随访次数、开始使用 SSRI 时的就诊次数以及开始使用 SSRI 时的诊断。接下来确定了一批年龄(+/- 2 岁)、随访时间(+/- 2 年)和配对病例开始使用 SSRI 时就诊诊断相同的从未使用者。在这些人中,选择Mahalanobis 距离最短的匹配对照。不断重复这一过程,直到将所有 500 个事件用户全部配对完毕。然后进行了第二轮匹配,得到了 N=1,110 的大约 1:2 匹配样本。在全面分析组中通过一系列线性混合效应模型评估了使用 SSRI 与总体认知变化之间的假设关联。在敏感性分析中,作者又对这些模型进行了额外的协变量分析。接下来在混合效应模型中评估在研究期间开始使用 SSRI 的影响,并将变化点锚定在开始使用 SSRI 时。通过这些模型可以比较开始使用 SSRI 之前和之后的认知能力下降率。为了评估开始使用 SSRI 之前和之后抑郁症状的变化,作者构建了一系列广义线性混合效应模型,将抑郁症状(CES-D 评分)作为有 6 个等级(0、1、2、3、4、≥5)的序数纵向变量。
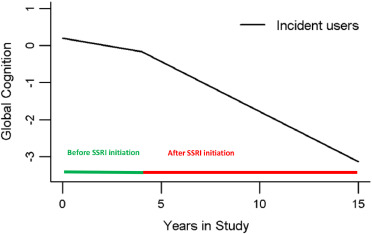
Figure. 2. Global cognition trajectories in participants who initiated SSRIs during follow-up: (from a mixed-effects change point model that allowed rate of decline to shift after initiation of SSRI use with adjustment for age, sex, education and depressive symptoms)
在该分析中,无 SSRI 亚组的总体认知分数平均每年下降 0.130 个单位,SSRI 亚组的总体认知分数平均每年下降 0.202 个单位(0.130 + 0.072),比无 SSRI 亚组的下降速度快约 55%。在这项分析中,抑郁症状与分析基线时的认知能力下降有关(Estimate=-0.034, SE=0.013, p=0.0080),但与认知能力下降的速度无关。 在没有认知障碍的人群中,未服用 SSRI 亚组的总体认知评分平均每年下降 0.093 个单位,服用 SSRI 亚组的总体认知评分平均每年下降 0.155 个单位(0.093 + 0. 062),比未服用 SSRI 亚组的速度快约 67%;在 MCI 患者中,服用 SSRI 与认知能力下降的相关性与未出现认知障碍的患者中的相关性没有差异;在痴呆患者中,服用 SSRI 与每年平均多下降 0.055 单位的认知能力下降相关。在这项分析中,抑郁症状(CES-D)与认知能力无关(估计值=-0.014,SE=0.008,p=0.092),也与认知能力随时间的变化无关(估计值=0.001,SE=0.003,p=0.852)。敏感性分析中没有发现 CESD 和 SSRI 与认知(CES-D x SSRI;p=0.32)或认知随时间的变化(时间 x CES-D x SSRI;p=0.95)有任何交互作用。
本研究中的病理模型反映了死前几十年大脑中累积的神经退行性变化及其对渐进性认知衰退的影响。本文结果表明,认知变化与 tau 而非 SSRI 有关。
原始出处:
Sood A, Wilson RS, Yu L, Wang T, Schneider JA, Honer WG, et al. Selective Serotonin Reuptake Inhibitor use, age-related neuropathology and cognition in late-life. Psychiatry Research. 2023;115471.
作者:xiongjy
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言