肿瘤中的中位PFS:不能过度迷信,这里也有陷阱
2020-03-16 小凡生统月谈 小凡生统月谈
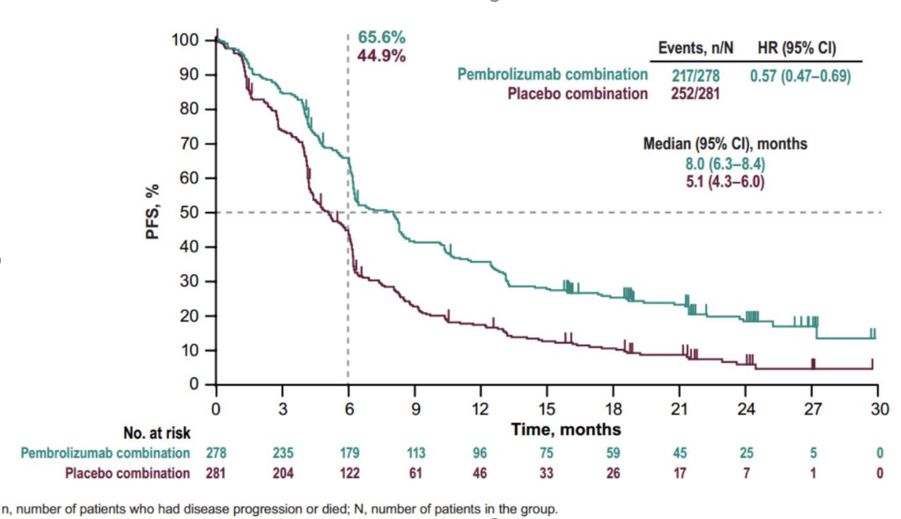
在2019年ESMO上, keynote 407研究更新了最新的结果。在更新的结果中,帕博利珠单抗联合化疗对比安慰剂联合化疗的中位无进展生存(PFS)时间分别为8.0个月对5.1个月,相差近3个月。中
keynote 407研究主要分析结果
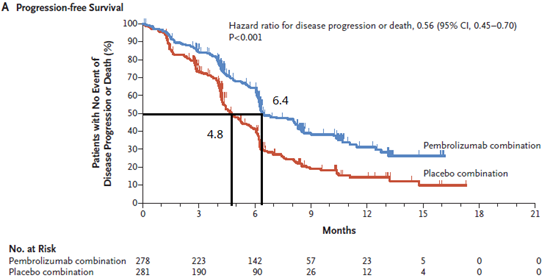
keynote 407研究2019年ESMO更新结果
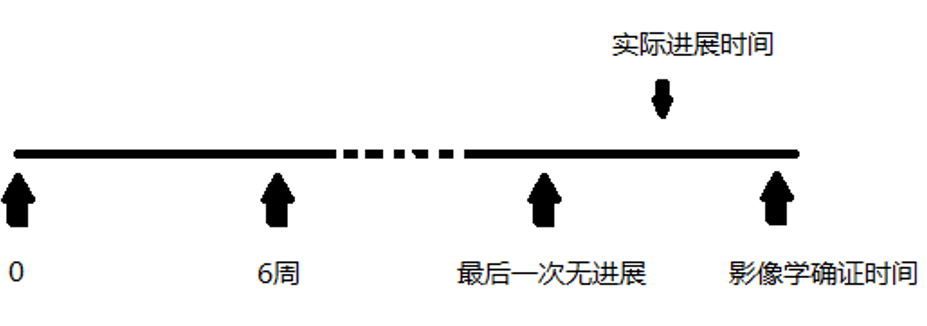
2. PFS的区间删失性质
-
右删失型(right censored)指的是我们知道事件(如死亡)时间是在我们删失的时间(如一个脱落病人的最后一次访视日期)之后发生;
-
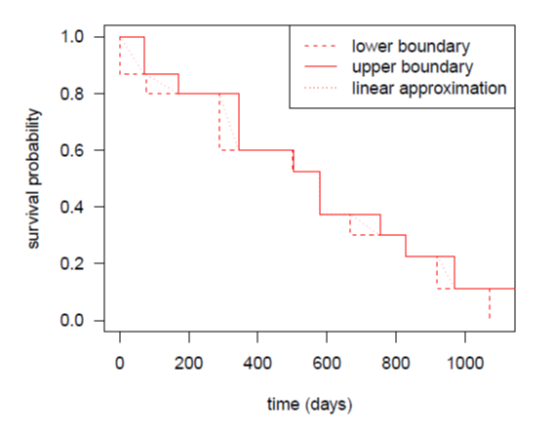
区间删失型(interval censored)指的是我们知道疾病进展是在两次评估间发生了,但我们却不知道在这个时间段内真正发生疾病进展的时间在哪里(如上图所示)。在实践中,统计师通常使用首次观察到疾病进展的影像学确认时间近似来填补真正疾病进展的时间,并利用传统右删失的方法进行统计分析。这种偷懒的方法直观、简单、尽管粗糙。
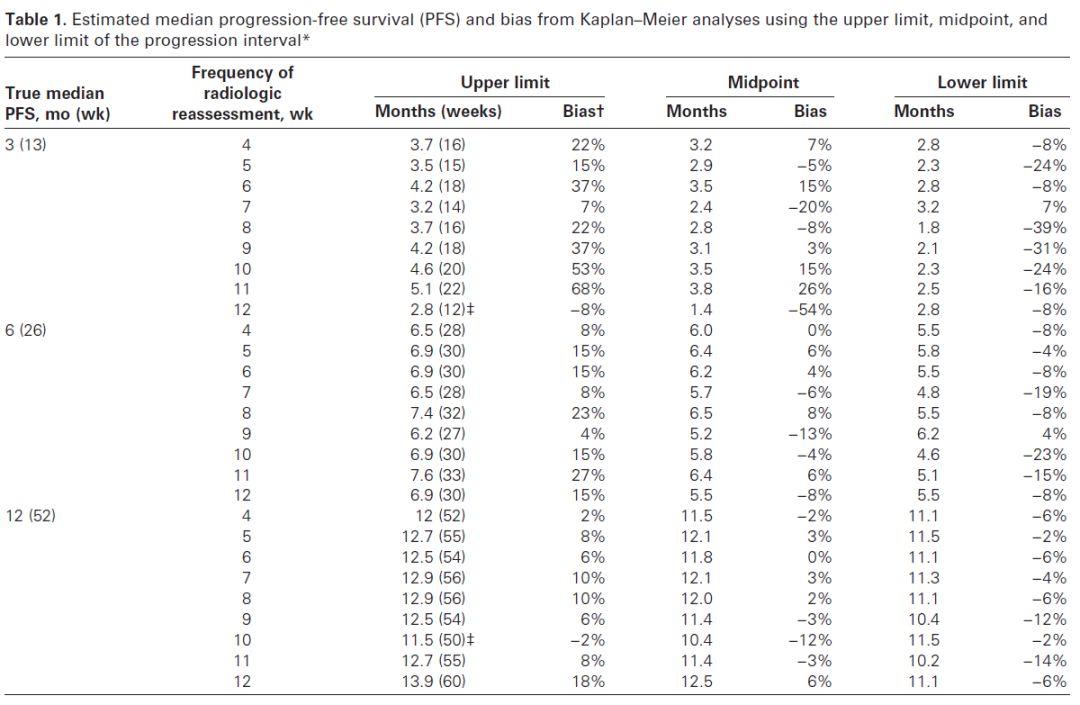
可以从上面的表中看到,不同的对真实PFS时间的填补方法会产生不同的结果,或拉长或缩短。目前通用的填补方法,其本质会人为的拉长估计的中位PFS时间,尤其是当评估间隔更长时更严重。因此当我们解读PFS数据时一定要同时关注评估计划才能更准确的了解真实的药物疗效。
3 模拟解读:评估间隔对中位PFS组间差值估计的影响
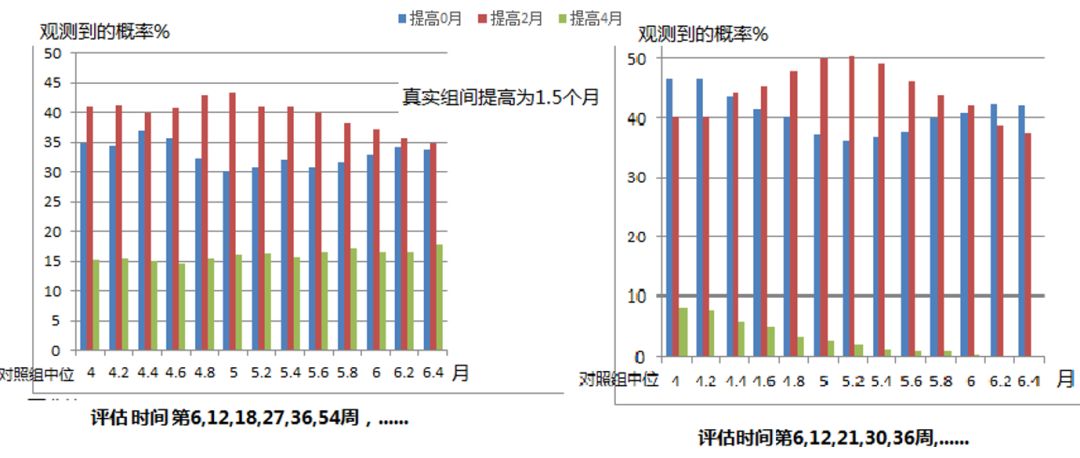
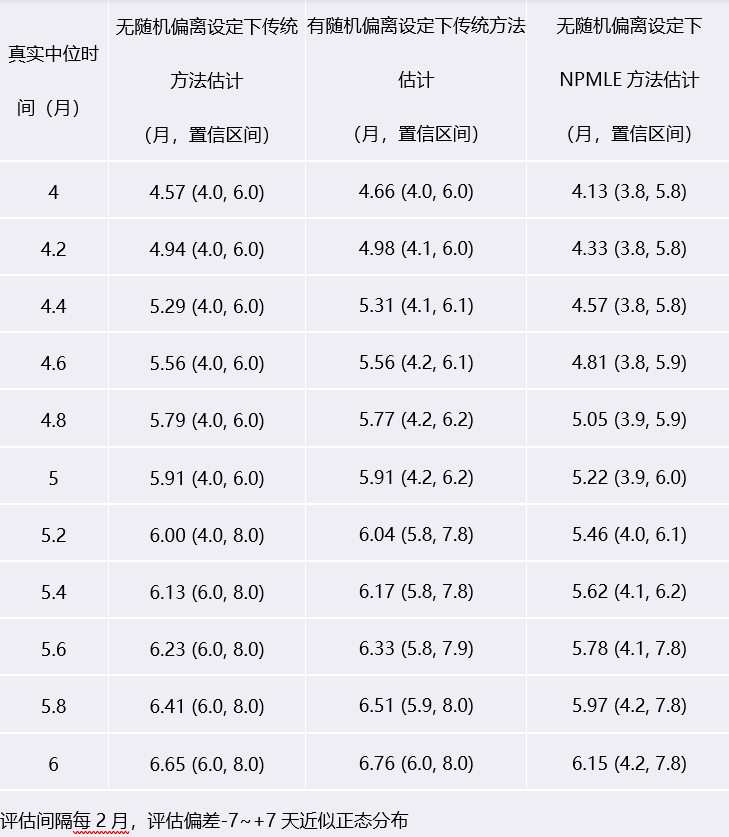
4 延伸:风险比(HR)与肿瘤评估间隔

[1] Nonparametric Estimation of a Survivorship Function with Doubly Censored Data. Bruce W. Turnbull. Journal of the American Statistical Association, Vol. 69, No. 345. (Mar., 1974), pp. 169-173.
[2] When You Look Matters: The Effect of Assessment Schedule on Progression-Free Survival. Katherine S . Panageas , Leah Ben-Porat , Maura N . Dickler , Paul B . Chapman , Deborah Schrag., Journal of National Cancer Institude 2007;99: 428 – 32
作者:小凡生统月谈
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#PFS#
48