杨水祥 岳语喃:CFAE消融治疗房颤的全新策略
2013-05-15 杨水祥 岳语喃 心网
摘要: 肺静脉隔离(PVI)是导管消融治疗心房颤动(AF)的主要方法。消融靶点为复杂心房碎裂电位(CFAE)的消融方法不仅AF终止率较高,而且在没有肺静脉隔离(PVI)的阵发AF或者持续AF中都取得了良好的效果。本文将讨论CFAE指导下的独立消融或结合肺静脉隔离的房颤消融如何在临床上制定合理有效的消融策略。 1.前言 确定
摘要:
肺静脉隔离(PVI)是导管消融治疗心房颤动(AF)的主要方法。消融靶点为复杂心房碎裂电位(CFAE)的消融方法不仅AF终止率较高,而且在没有肺静脉隔离(PVI)的阵发AF或者持续AF中都取得了良好的效果。本文将讨论CFAE指导下的独立消融或结合肺静脉隔离的房颤消融如何在临床上制定合理有效的消融策略。
1.前言
确定AF射频消融靶点的理想方法是找到导致心律失常的基质。过去认为AF基质不能被描记,因为基质内的折返环是随机的,所以不能用点对点或心内膜标测对房颤的基质进行标测。目前认为,PVI为AF导管消融的基石,大多数医院将其作为阵发性AF患者的主要治疗方法。但最近Nademanee等人研究发现,找到心房复杂碎裂电位(CFAEs)就可以找到导致房颤的基质。持续性房颤的病例中,CFAEs通常显现在心房的某些特定区域,表现出时间和空间上的稳定性。研究表明,通过消融有持续性CFAE记录的区域能够使超过85%的患者房颤消失,说明CFAE消融用于治疗阵发性和慢性房颤有非常良好的长期预后。本文将综述一些有代表性的病例,对CFAE消融单独或结合PVI的实际操作进行分析,以进一步了解新型导管消融方法。
1.1 CFAEs指导消融:找到消融部位的关键
心房复杂碎裂电位(CFAEs)被定义为有两个或两个以上连续的心房碎裂波组成,及/或基线在较长一段时间里持续波动伴有持续的延长除极波。CFAE电压的振幅较低(范围:0.04〜0.25毫伏),周长短(≤120ms),短于心房其他部位,有或没有多重电位。
CFAE的定义很简单,但电图特性较难理解。CFAE表现出时间和空间的稳定性,因此识别CFAE成为终止房颤的关键。 当AF变为有规律或者转化为房性心动过速(AT)或扑动(AFL)时,电位图会发生改变。有趣的是,一些同时患有房颤和AT/AFL的患者在进行消融前上述心律可以自发切换。这种情况同样发生在一些接受CFAE导管射频消融(RF)的患者身上。图1显示了在射频消融前的CFAE以及RF终止AF的电位图。尽管AF变得规律,转化为AT/AFL后,CFAE也变得规律,典型的连续性CFAEs是很容易被识别。此外,曾经被消融过的小电位区域也很重要。CFAEs不是以稀疏的点存在的,在一些致密部位也能找到(CFAEs exist not as sparse points, but are found in some dense areas.)。将CFAE区域消融后,心电图会改变,电压会降低,碎裂程度减少和/或变得更有规律。如何寻找残余CFAE电位仍是一个问题。由于CFAEs有时间和空间稳定性,我们试图标记以前消融区域来确定残余CFAE电位的位置,偶尔用尼非卡兰(Nifekalant)增加AF周长来确定剩余CFAEs电位的位置。Nifekalant本身可以终止房颤,然而我们发现使用Nifekalant不影响结果。
除了当房颤转化为稳定的AT/AFL,一般不需要对射频区域重新标记来识别残余CFAE电位位置。我们偶尔会尝试通过激活描记部位来找到残留的CFAE电位而终止AT/ AFL,而不是使用线性消融。将消融前观察到大片CFAE电位时,绘制精确的CFAE描记图十分有用。CFAEs不是稀疏的点,而是存在于一些致密的区域,但整个LA精确描记并非必须。
图1:
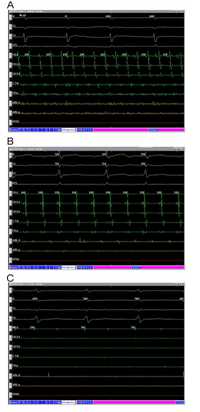
图1:心房复杂破碎电位(CFAEs)。用消融导管(ABL d)来标记和消融CFAE。(A)持续性CFAE的典型电位图。这是CFAE消融的第一个靶点。(B) 规律的碎裂电位典型电图。这在那些AF变得规律或者转化为房性心动过速或房扑患者中可以见到。这是在既往消融靶向持续性CFAE后观察到的电位。该区域经过射频消融 (RF) 后心律失常消失。(C) 极低振幅碎裂电位的典型电位图,最高电位为0.06 mV;这也是在既往消融过的部位发现。该区域经过RF后,心律失常消失。CS=冠状窦
1.2 CFAE电位的区域分布
即使在CFAE 描记中未检测到CFAE电位的位置,也可以根据经验在CFAE多发区寻找消融达到终止房颤的目的。以下区域为CFAE电位常出现位置:(1)房间隔前部至肺静脉上方或者下方,(2)左心耳(LAA)前壁,(3)接近左上PV的后上壁,(4)左心耳和左上PV之间区域,(5)冠状窦(CS)远端和CS窦口,及(6)上腔静脉(SVC)与右心房(RA )连接处到RA间隔,这和(1)是对应的。通常情况下,持续性房颤患者比阵发性房颤患者可标测出更多的CFAE电位。
1.3 CFAEs的电生理学机制
关于CFAE的发生机理最多的是心脏固有神经系统对心房组织的复杂作用。心脏神经节(ganglionic plexi,GP)是心脏交感神经和副交感神经传入和传出的自主神经组织集合。图2A 显示了6种主要GP的部位。Lockwood 等人报道说与持续性AF患者相比较,阵发性AF患者CFAE的分布与GP的分布类似(图2B)。图2C–E显示了CARTO描记的例子,阵发性AF患者中消融部位与GP部位分布类似,而在持续性AF患者却较难发现这种现象。我们推测CFAE可能代表了一种生理学上的病态细胞,它的去极化不稳定,心电图也就是碎裂的。因此,心房牵拉可能是CFAE发生的原因,病毒感染导致的心房心肌病可能是另一个原因。有人报道了一种炎性生化因子- toll样受体2(TLR2)-在非瓣膜性AF患者中与没有AF患者相比较升高了。 
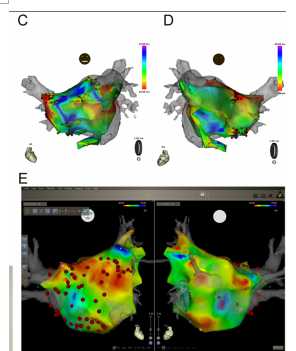
图2. (A)显示左右心房和PV附近六个心脏GP的位置,这些GP能影响心房颤动(AF)的启动和维持:左心房上方GP,左心房后外侧GP,左心房后内侧GP,左前下GP,右心房后侧GP,以及右心房上方GP。AP:前后;PA:后前; LAA:左心耳;RAA:右心耳;CS:冠状窦;LOM:Marshall韧带;SVC:上腔静脉; LSPV:左上肺静脉;LIPV:左下肺静脉; RSPV:右上肺静脉;RIPV:右下肺静脉。(B) 暗色部位为左右心房中CFAE最常见部位。 LA:左心房;LAA:左心耳;RA:右心耳;CS:冠状窦;FO:卵圆窝;LSPV:左上肺静脉:LIPV:左下肺静脉;RSPV:右上肺静脉;RIPV:右下肺静脉。(C)和(D)分别是一位阵发性AF患者自主电描记的前后位图(C)和后前位图(D),该患者射频消融的部位近似于GP的部位。(E)为一名有1年持续性AF病史患者自主电描记的前后位图(左图)和后前位图(右图),消融区域与GP分布不同。消融区域更常出现在LA前部和接近后部的间隔部。
2.方法
下面将讨论CFAE射频消融术的方法,包括CFAE消融联合PVI。
2.1 CFAE射频消融的具体方法
2.1.1 单独CFAE指导下的射频消融术
CFAE在空间和时间上的稳定性使我们能够通过电极精确定位。然后将标记图上的粉红色点作为CFAE消融的标志。这些极其有用的标记图能够最大限度地减少曝光。很快消失(fleeting)的CFAE部位不作为首选目标。初始CS和LA的描记是进行CAFE射频消融最重要的一步。
Pruka 装置(SJM)有助于识别CFAEs。常用的范围与EP-工作系统类似 (EP
Medsystems, West Berlin, NJ, USA)。晚近已经研制出了一种定制的软件包能够协助描记(CFAE软件模块,CARTO, Biosense-Webster)。最短波群间期(SCI) 描记在手术中经常应用。有关变量的信息根据色彩编码被投射到已建立的3D电自主外壳(LA模)。明显CFAE部位标记为粉红色。消融能量设定最高为40 W,后壁接近食管和CS部位为15W。RF时间通常为40秒。我们还在冠状窦和冠状窦口,隔膜部, 外侧峡部, SVC, 以及右侧间隔部寻找CFAE。CFAE射频消融最重要的一个方面是能够再次找到已经消融过的区域,以确保该区域没有残留电活动。如果一个患者所有可见的CFAEs都被去除后仍为AF,静脉使用nifekalant (剂量, 0.3 mg/kg 超过10分钟; 最大剂量可重复两次)用来增加心房“非驱动”部位心律失常的周长长度,进而可以找到射频消融最重要的部位。
在CFAE靶向的AF射频消融中,心律失常经常能够演化为AF或者AT/AFL(图3)。 使用CS导管作为参考, 对AT/AFL进行消融。AT/AFL起源最常见的部位和CFAE定位是一致的,这正是AF射频消融手术最开始标记的部位。我们定义的终点为 (1) 恢复窦律 (如果是阵发性AF,AF应该不能被重新诱导出来), 或者(2) 所有的CFAEs被清除。少数情况下,即使使用了nifekalant,患者在清除了所有CFAEs的严格射频消融手术后仍然为AF或者AT/AFL,这些少见的患者需要复律。 如果AF没有终止或者自发再诱导出来(这种情况罕见),通常情况下重复寻找残存的CFAE部位来维持窦律。CFAE描记结束后,LA 鞘管和Navistar 导管有时候从LA移到RA (有意或者无意),一种“虚拟LA鞘管显像”的方法(图.4)有利于重新置入LA。房间隔穿刺后,建立CS的SCI描记,SL0置于LA, 使用CARTOSOUND将11F鞘管置于RA来监测有无心包积液。
2.1.2. 联合PVI
大多数医院将PVI作为AF患者的一线治疗。PVI联合CFAE与单独CFAE指导下进行射频消融在方法上有很大不同。当PVI 没有终止AF时,使用 Single Lasso (Biosense Webster)或者Optima (SJM)来完成隔离,如果AF仍能被诱发出来,继续CFAE消融指导AF不能被诱发。在一些患者中,PVI仍不能维持窦律。尤其是那些持续性AF患者,这些患者PVI可在CFAE射频消融后完成。
{nextpage}
2.2. CFAE射频消融的工具
CFAE射频消融有一些有用的工具,下文将讨论这些工具的好处。
2.2.1. CARTO3和CARTO-Merge
CARTO3和 CARTO-Merge有助于我们在相对较短的曝光时间中完成AF射频消融。使用CARTO3后单独CFAE指导射频消融的平均曝光时间是10分钟,联合PVI为17分钟。CARTO-Merge在CFAE射频消融中是不需要的。CARTO-Merge的获益包括以下方面: (1)在重建后可以很安全的完成整个LA的描记。能够减少血性心包积液(hemocardium)的风险.(2) 使用CARTO-Merge能够了解心房和CS的精确解剖结构,在PVI时可能不必进行PV造影。更重要的是重建图像与实时描记相吻合。
2.2.2. CARTOSOUND
CARTOSOUND 已在日本上市。CARTOSOUND益处包括以下:(1) 因为在注射生理盐水后可以检测到微小声泡,所以进行间隔穿刺时不需要造影剂(图 6A)。(2) The images of CARTOSOUND成像质量高,有助于检测左房LAA血栓。假如检测到了LAA血栓,AF射频消融治疗就不能实施,因此通过CARTO-SOUND可能会减少低危患者行经食道超声检查。(3) CARTOSOUND有助于食道的检测(图6B和C)。CARTOSOUND可以检测到食管的实时位置。食管的位置在手术过程中不是一直稳定的,在消融LA后壁时有必要监测食管的实时位置。(4) CARTOSOUND能够检测心包积液。将CARTOSOUND置于RA以监测手术过程中是否出现心包积液。心包积液经典的检测方法是动脉压力下降。在其他手术中,使用CARTOSOUND计算LAA流速。
2.2.3. CARTO3监测的温度探针
虽然食管温度监测可能不能完全保证避免发生食管损伤, CARTO3下可视化的食管探针能够让我们进行食管温度的测量(图6B,C,和7)。在不使用造影的情况下,探针的位置可以与消融导管的位置切合。 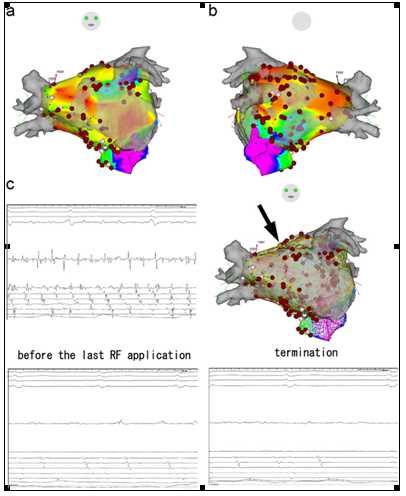
图3. 一位持续性AF患者使用CARTO的电伏描记和心内电位图。一位46岁长于1个月的持续性AF患者,AF不能转为窦律: (a) CARTO电伏描记的左房(LA)和冠状窦(CS)的前后位图。粉红色点代表消融前CFAE的心内电位。蓝点代表二尖瓣环。黄点代表房性心动过速(AT)的终止点。(b) CARTO电伏描记图的后前位图。(c) 右上方的图表示使用CARTO描记的LA和CS的网状图的前后位图。左上方图表示位于右上肺静脉底部的腔内心电图,这是一个CFAE。在该患者中,AF转化为AT (周长356 ms)。在AF转化为AT后,仍然是破碎电位,虽然电位图似乎“规律”了(左下图)。底部的图显示了AT在LA顶部进行射频消融(RF)前后的心内电位图(黄点,箭头所指;经过RF后一直保持为窦律。为了终止AT,没有使用线性消融。消融的主要部位包括: (1)间隔底部,(2) LAA脊部,(3) LA顶部, (4) CS近端,(5)左PVs的后面,以及(6) LA后壁的底部。RF时长137分钟。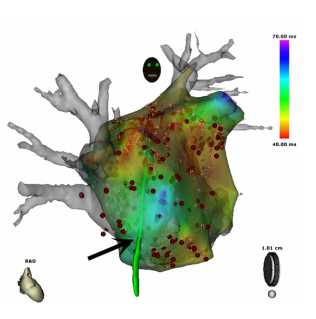
图4. “虚拟左心房(LA)鞘成像的例子。这种显像在LA鞘和导管有意或无意从LA进入到右心房需要重新放置时很有用。我们可以很容易地通过这种显相方法找到正确的插入孔洞。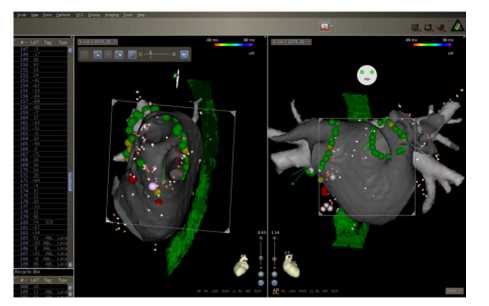
图5.一例阵发性AF的病例。肺静脉隔离 (PVI, 绿点)联合CFAE 消融 (红点)。仅仅使用PVI就能够将AF终止多次 (黄点)。在这种情况下,一些地方需要联合CFAE 消融。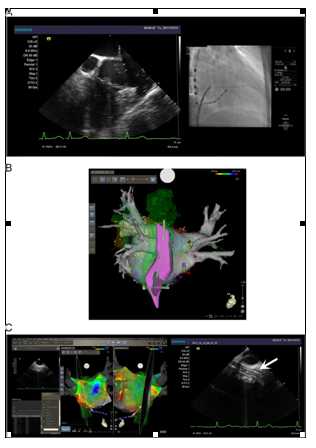
图6. (A)房间隔穿刺;注射生理盐水后产生的隆起和微泡(左图)。房间隔穿刺不需要造影剂 (右图)。(B) CARTO描记的后前位图,食管的位置通过融合CT显像、温度探针和CARTOSOUND的食管描记被估算出来。(C) CARTOSOUND探测食管,当温度探针置于食管中时,它能够清楚地检测到,当温度探针不在食管中时,它也能被CARTOSOUND检测到。
3.结果
3.1 Dr. Nademanee’s 中心的CFAE引导下的AF射频消融
自2006年1月至2007年12月接受CFAE指导下射频消融手术616名患者(206名阵发AF,410名持续AF)。这组病人中,阵发AF患者中通过CFAE靶射频消融成功终止AF转为窦性心律的有效率为99%(203/206),持续AF中的有效率为80% (328/410),偶尔需要使用伊布利特。其他患者需要进行体外转律和维持窦律治疗。CFAE的共同部位位于右PV的前部,左PV心房的后部,LAA的脊部,CS远端,RA的后侧(图8)。同时分析了从2005年1月到2006年6月的410名接受CFAE指导下AF射频消融的患者(平均年龄63岁),这些病人随访了至少12个月(平均28±8个月),阵发性AF患者需要再次手术者38%,持续性AF患者需要再次手术者为47%。年龄、RF时间以及是否需要伊布利特或者心脏转律治疗对于再次需要手术不是很好的预测指标。LA容量(p=0.047)以及体重指数(BMI,p=0.016)是很好的预测指标。需要再次手术组的患者使用CARTO测量出来的LV容量是143cm3,而不需要再次手术组患者的LV容量为130cm3。因此,AF射频消融应当在LV相对较小的时候进行。
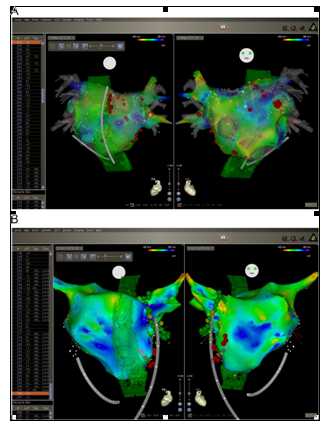
图7:(A)食管融合图像的位置和该患者的实时食管探测位置是相似的。
(B)食管融合图像的位置和该患者的实时食管探测位置截然不同。
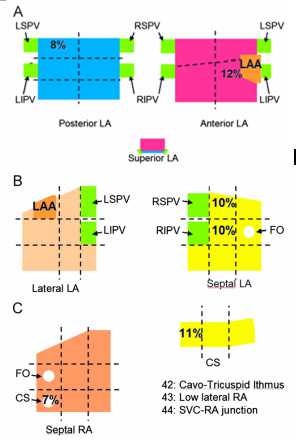
图8:终止心房颤动(AF)的公共区域,数字表明了在该区域终止房颤的比例。(A)左心房的后壁和前壁。(B)LA的外侧壁和间隔壁。(C)右心房和冠状窦的间隔壁。我们定义三尖瓣狭部, 上腔静脉-右心房交界处,以及右心房下外侧作为每个区域的一个部位。
3.2 CFAE指导射频消融终止房颤
一组2008年9月到2012年2月行CFAE指导下射频消融手术的340名患者(187名阵发AF,153名持续AF),不管CFAE靶点包不包括PVI,其中98%的阵发AF和78%的持续性AF转为窦律。偶尔使用nifekalant而不是伊布利特来发现残留CFAE。
3.3 通过PVI终止AF
虽然终止AF可能不需要PVI, 但是以PVI为基础的终止AF策略报道提示有良好的预后。图5展示了一名 CAFE联合PVI射频消融的患者。我们通常将PVI放在CFAE之前以明确PVI对于终止AF的有效性。在图5的患者中,PVI能够反复将AF终止,仍需要清除残留CFAE部位的RF,包括很少的游离部位。据报道,在既往未行AF射频消融的患者中,PVI能够终止43%(13/30)的阵发AF,11%(2/9)的持续AF(AF持续时间<1年)。阵发AF中只有2名患者在PVI中没有被诱导出来。对于大多数阵发AF患者来说,PVI还是有效的。PVI对于治疗阵发AF的有效性局限于老年、肥厚性心肌病、LA容积增大、持续性左侧SVC(PLSVC)以及或伴有迷宫手术的患者。这些病人接受CFAE射频消融的治疗将在下面进行描述。
3.4 单独CFAE描记指导下的AF射频消融中使用非定向PVI与临床预后的关系
有报道评估单独使用CFAE靶点部位指导AF射频消融的有效性,试图明确它的临床有效性与非定向PV隔离有无关系。100名接受CFAE治疗的患者(年龄59± 11岁,阵发AF 54名,持续AF 35名,11名永久AF),在射频消融之间和之后,记录了PV的电位(PVP)。共有39名患者排除出组,因为在射频消融之前通过内复律窦律无法维持或者既往有PVI的病史。98%的阵发AF、80%的持续AF和55%的永久AF被成功转复。上述患者中分别有30%, 57%和 83%的病人使用了Nifekalant (剂量, 0.3–0.6 mg/kg)。PV周围的CFAE公共区域定位于右PV的前部,左PV的后部。61名患者(42名阵发AF,19名持续AF)的215个PV中,只有17个PV(8%)为非定向隔离。13%的PV中,心房电位到PVP时间延长(>30ms),经过至少12个月的随访(23±5个月),65%的阵发AF患者(11%使用药物),54%持续AF患者(37%使用药物),45%的永久AF患者(60%使用药物)经过1次治疗后房性心律失常消失。43%(26/61)患者的局部心房电位到PVP时间延长,或者至少1/4的PV被隔离。本研究中经CFAE指导射频消融的临床预后与是否行PVI无关。他们认为不使用PVI进行CFAE射频消融终止房颤的比例很高,显示出了良好的临床预后。
3.5 CFAE射频消融的并发症
来自Pacific Rim的数据,635名卒中高危的AF患者接受了CFAE指导的射频消融,5名患者出现了脑血管病意外(CVA)(0.8%);CVA的2名发生在24-48小时内;9名患者出现了血性心包积液(1.4%);其中1名由于LA穿孔需要外科修复,6名患者最终需要心包穿刺术。13名患者在腹股沟股动脉穿刺处出现了血管并发症(7个假性血管瘤,2个动静脉瘘,4个严重出血,其中有1个腹膜后出血需要输血治疗,2个出现了高度的房室传导阻滞并且需要植入永久起搏器,3个术后出现了一过性的肺水肿,后经利尿治疗后缓解)。没有发现严重的操作相关晚期并发症,比如食管心房瘘、肺静脉狭窄。没有发生操作相关的死亡。但是有2名患者在手术后30天内死亡。其中一名患者在48小时内发生了CVA,数周后去世。另外一位患者是因为慢性阻塞性肺疾病和肺炎导致呼吸衰竭去世。
3.6 CFAE指导下AF射频消融后出现无症状性脑微血栓的发病率
有报道CFAE伴或者不伴PVI射频消融术后出现脑微血栓的发生率,100位AF患者(50位为阵发AF,50为持续AF,其中10位为长时间持续AF)接受了CFAE指导下的射频消融,其中PVI+CFAE组为41人,单独CFAE组为59人。射频消融的患者中有5名患者因为3D CT怀疑冠脉狭窄而在射频消融前接受了CAG检查并且没有植入支架。终止AF后,使用环形导管进行PVI后的额外消融。所有的患者在射频消融术后第二天都接受了包括弥散相和T2加权相的脑核磁(MRI)检查,7.0%的患者发现了新发栓塞,并且2组患者之间无显著性差异。(联合组7.3%,单纯CAFE组6.8%)。在有无新发血栓的患者中,充血性心力衰竭、高血压,年龄>75岁,糖尿病以及既往有卒中病史(CHADS2评分)为(1.671.0 vs. 0.870.9, p<0.05,LA容量(LAV; 83.8727.1 vs.67.8721.8, p<0.05,左室射血分数(LVEF, 53.179.2 vs. 65.179.7,p<0.01, 都有显著性差异。在一个多变量研究分析中,LVEF (OR=0.92; 95% 可信区间 [CI], 0.84–0.99; p<0.05和合并CAG(OR=18.82; 95% CI, 1.77–200.00; p<0.05= 为新发脑梗的预测因子。我们认为CFAE射频消融后新发脑微血栓的发生比例不比以前PVI的比例高。AF射频消融过程中要小心,尤其是对于低LVEF的患者。
{nextpage}
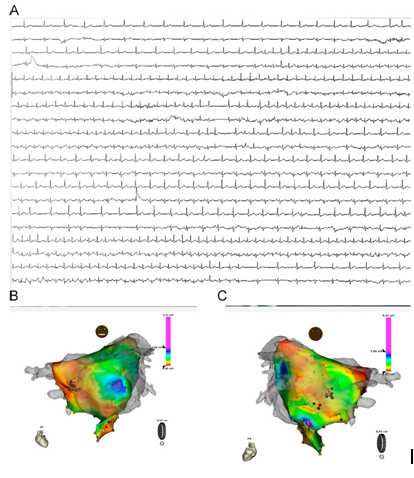
图9:复发性心房颤动(AF)的病例:(A)该患者Holter结果。(B)CARTO描记的前后位图。(C)CARTO描记的后前位图。未进行PVI消融,在复查Holter时发现只有很少的房性早搏(PACs)
3.7 未来的方向
在特定人群中,所有类型的AF使用射频消融比药物治疗更为有效。回顾性数据表明AF射频消融手术在病死率上优于传统治疗。心衰患者中有40%合并有AF,这些患者中使用射频消融手术恢复窦律对于提高心功能、改善症状、活动耐量以及生活质量都有好处。Nademanee 等人发现接受CFAE指导的导管射频消融手术患者在3个月后停用华法林时脑卒中减少了。这项研究的患者为慢性AF、高龄以及LA增大、结构性心脏病以及心力衰竭的患者。
关于患者的选择问题,已经明确仅有PVI治疗就有足够的获益,额外扩大消融可能不需要,但仍有一部分患者在PVI后需要小范围进行CFAE消融治疗。目前为止,这部分病人在射频消融之间不能被甄别出来。另外,有报告指出长时间随访发现单独使用PVI治疗对于阵发性AF患者的获益也是有限的,并且即使对于没有联合CFAE射频消融的阵发AF患者,如果PVI后需要重新手术治疗时,大多数电生理学家都很挠头,不能确定下一步怎么办。尽管如此,我们平均的RF时间较单独PVI治疗还是延长,卒中率(包括无症状性卒中)相对较少或者一样,血性心包积液没有增多,没有发生诸如LA-食管瘘或者症状性PV狭窄之类的严重并发症。因此,我们不认为单独PVI为AF射频消融治疗的唯一一线治疗,大部分AF患者将CFAE作为一线治疗时获益更多。
CFAE指导下的射频消融治疗并没有被其他人完全重复,希望本综述能够对CFAE治疗有所帮助。未来研究的兴趣点包括发现联合心电图和解剖结构指导射频消融方法,通过最简单的手术和最少的并发症来治疗所有的AF患者,不仅仅要缓解病人的症状,更要减少卒中等血栓事件的发生。最后列出一些比较有代表性的病例供大家参考。 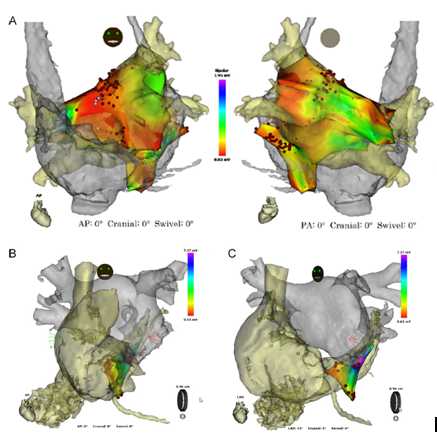
图10:心房颤动(AF)伴永久性左侧上腔静脉(PLSVC)的1个病例。
(A) AF合并PLSVC通过CARTO描记的前后位图以及后前位图。
(B) AF在PLSVC远端消融终止。
(C) 病例2:阵发AF伴有PLSVC:通过CARTO描记的前后(B)和左前斜(LAO.C)位图。我们需要将CS/PLSVC近端部分消融直到AF不能被诱发出来,该患者左房未被消融。
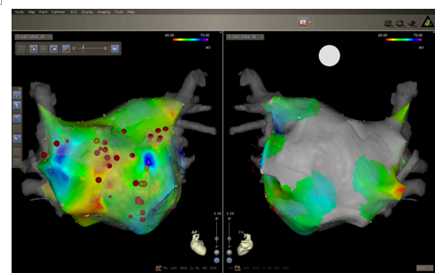
图11:1名既往行迷宫手术的患者出现了持续性一个月AF:CARTO描记的前后位(左侧)和后前位(右侧)位图,主要消融部位为前壁和间隔壁。
4.CAFE消融的代表病例
4.1复发性AF
PV的远端被认为是由于房性早搏(PAC)导致AF的唯一病灶。如果这样的话,CAFE消融后只会残留很少的PACs。有一个复发性AF的女性(图9),症状很典型,但是即使应用了异丙肾上腺素也没有将复发性AF诱发出来,持续性AF被异丙肾上腺素引起的快速性房率诱发出来,在没有PVI的情况下使用CAFE进行了AF的消融治疗。随访3年,该患者房颤未复发,并且多次行Holter心电图检查她的PAC<10次/天。该患者并没有将PV远端消融。还有一些患者在AF终止后出现频发PACs,这时候需要在上次AF消融的附近部位进行消融来治疗PACs,我们不需要PV远端消融。因此PV远端可能不是PACs的主要激动区。
4.2伴有PLSVC
PLSVC是Marshall韧带的组织学始祖,它被证明在AF的启动和维持过程中起作用。Hsu等人证明PLSVC是AF的心律失常来源之一,在4/5 AF患者中PLSVC可以从双侧心房中分离出来。既往报道过一名伴有PLSVC的AF患者接受了CFAE指导下的AF射频消融。目前为止,已经有三例这样的患者报道。当AF部位在远端的时候,将PLSVC远端分离出来可能有用。虽然有一名患者AF部位在CS/PLSVC的近端。在这名患者身上,曾经将CS/PLSVC远端消融,而不消融LA,直至患者的AF不能被诱发出来。因此,CFAE射频消融对于AF伴有PLSVC的患者来说似乎是一个适合的方法。
4.3迷宫(Maze)手术后
大部分结构性AF射频消融手术是基于迷宫手术。因此既往曾行迷宫手术的患者采用解剖性方法进行射频消融是比较困难的。一例既往曾行迷宫手术的患者(图11),5年前行三尖瓣成形术,4年前开始出现持续性AF,迷宫手术后,该患者AF多年未再发。但后来持续性AF再发1月,并且症状很明显,进行了CFAE射频消融。该患者LA后壁在迷宫手术中已经分离,因此将前壁和间隔部位射频消融后即终止AF。术后患者AF不能被诱发出来,直到现在还是窦律。
5.结论
虽然AF终止并不完全意味着较好的预后,CAFE射频消融对于大多数AF患者来说都是有效的。CAFE射频消融在一些患者身上可能需要重复进行。在再次消融时,需要将上次射频消融的部位重新消融。由于射频消融导管能够将整个区域消融来清除所有的CAFE部位,CFAEs射频消融的预后将会提高。CAFE仅仅是一种消融策略,我们还需要不断发展新的方法,联合解剖结构策略,减少并发症,缩短手术时间和曝光时间,进一步改善患者预后和获得最好的效果,是我们不断追求的目标。
作者:杨水祥 岳语喃
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#CFAE#
39
#消融#
33
#新策略#
43
#消融治疗#
30