清华大学最新Science子刊: “一石二鸟”口服纳米疗法,治疗溃疡性结肠炎
2024-08-04 BioMed科技 BioMed科技
作者的研究为结合LMWH基础的整合素靶向与肠道氧化还原稳态调节的“以一举二”策略提供了强有力的验证,突出了OPNs@LMWH在UC治疗中的应用潜力。
溃疡性结肠炎(UC)是一种大肠的慢性复发缓解型炎症性疾病,其全球发病率和患病率迅速增加,然而这种疾病仍然无法治愈,且具有多方面的病理生理特征。欧洲克罗恩病和结肠炎组织以及美国胃肠病学会建议患者通过使用化学药物或单克隆抗体的阶梯式治疗来达到预期的缓解效果,因为目前尚无已知的临床有效治愈方法。然而,传统小分子治疗药物或生物基免疫抑制药物的频繁和长期使用可能导致严重并发症,如机会性感染、恶性肿瘤、自身免疫和肝毒性。因此,设计和开发有效的口服治疗剂和治疗策略对于UC非常重要,这可以通过基于炎症信号和药物递送方法的循证理解来发现活性成分和精准递送来实现。
在这项研究中,清华大学化学工程系邢新会教授、王怡助理研究员及清华大学深圳国际研究生院张灿阳助理教授开发了一种特定靶向的口服纳米疗法,作为“一个石头”,用于炎症的定向定位和调节氧化还原稳态,从而实现对UC治疗的“两只鸟”效果。作者设计的纳米治疗剂OPNs@LMWH(氧化敏感的ε-聚赖氨酸纳米粒子与低分子量肝素)同时展示了特异性主动靶向效果和治疗效果。作者的结果表明,OPNs@LMWH具有高效的整合素αM介导的免疫细胞摄取效率,并优先积累在发炎组织中。作者还在小鼠结肠炎治疗实验中确认了其疗效,通过改善氧化应激和抑制炎症相关信号通路的激活,同时增强结肠上皮的保护机制。总体而言,这些发现强调了OPNs@LMWH的双重功能性,能够有效口服递送到发炎部位,从而促进精确的UC管理。该研究以题为““Two-birds-one-stone” oral nanotherapeutic designed to target intestinal integrins and regulate redox homeostasis for UC treatment”的论文发表在最新一期《Science Advances》上。

在先前的研究中,精确药物递送被认为是一个重要挑战。成功的关键在于选择合适的靶向策略。目前已有多种策略用于靶向肠道炎症部位,如微生物酶降解、pH调节和黏膜电荷逆转。然而,胃肠道环境复杂多变,影响治疗效果的可靠性。由于免疫细胞在病变部位聚集,使用配体分子靶向免疫细胞可能更有效。单核细胞、先天淋巴样细胞和T细胞等免疫细胞及其调节因子在炎症性肠病中扮演重要角色。研究指出,免疫细胞循环的改变是UC中黏膜炎症和组织破坏的主要驱动因素,因此整合素α4β7和αMβ2是理想的靶点。在这一背景下,作者考虑使用肝素。肝素是一种阴离子多糖,通过未分级肝素(UFH)解聚制备的低分子量肝素(LMWH)已广泛用于临床。作者假设,通过口服给药的LMWH可以成为开发精确口服治疗UC的有前途的炎症部位靶向配体。
作者首先设计并合成了氧化敏感材料(OsEPL),通过在侧链氨基引入对ROS敏感的疏水苯硼酸酯基团。通过纳米沉淀和逐层组装方法制备了OPNs和OPNs@LMWH,形成带正电的纳米颗粒(OPNs@CS),然后与LMWH水溶液孵育制备OPNs@LMWH。根据扫描电子显微镜(SEM)、透射电子显微镜(TEM)和动态光散射(DLS)分析,OPNs@LMWH呈现出球形核壳结构,平均粒径约为600 nm,多分散指数(PDI)低于0.2。研究表明,OPNs@LMWH在储存期间和口服给药后具有优异的稳定性。
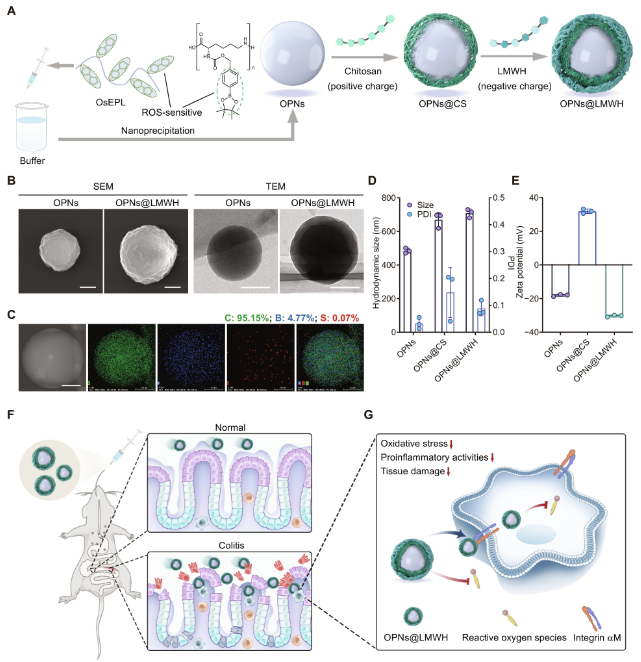
图1. OPNs@LMWH的制备与表征
接下来,作者比较了OPNs@LMWH和OPNs被促炎免疫细胞摄取的能力。通过脂多糖(LPS)和干扰素-γ(IFN-γ)激活RAW264.7细胞形成M1巨噬细胞,然后孵育带有荧光标记的OPNs(FA-OPNs)或FA-OPNs@LMWH,发现OPNs@LMWH的细胞摄取效率显著提高。通过流式细胞术进一步证实了这一点,表明这种增强的摄取效率是通过肝素与整合素αM的相互作用实现的。在饮用水中添加葡聚糖硫酸钠(DSS)构建结肠炎模型小鼠,以研究口服给药后OPNs@LMWH在体内的分布。结果显示,OPNs@LMWH在病变部位高积累,荧光信号在12小时达到峰值。相比之下,裸OPNs在健康小鼠和结肠炎模型小鼠体内更快被清除。结肠炎模型小鼠给予OPNs@LMWH后,颗粒在结肠中的积累显著增加。在健康小鼠中,OPNs和OPNs@LMWH都迅速从结肠中清除,而OPNs@LMWH在炎症结肠中持续存在,显示出其优异的炎症靶向能力。
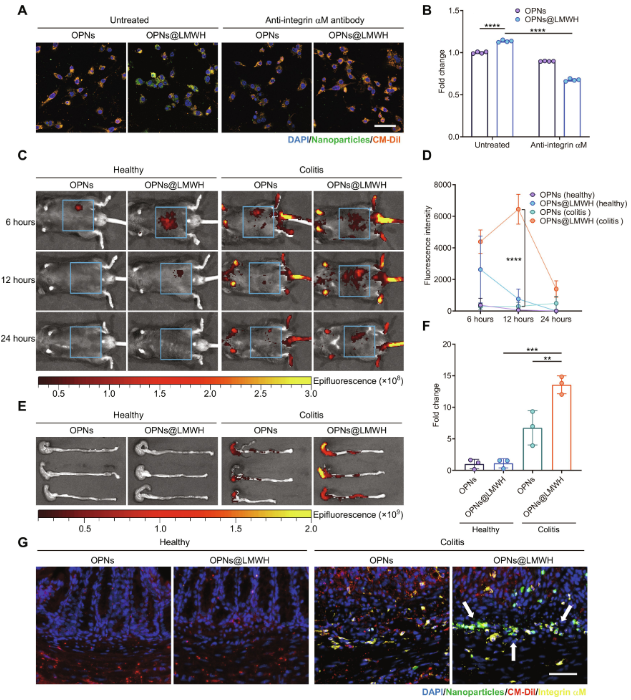
图2. OPNs@LMWH被M1巨噬细胞内化,并在炎性细胞浸润的炎性结肠组织中积累
调节氧化还原稳态是“杀两鸟一石”设计中的另一个关键点。在明确了OPNs@LMWH的精准靶向特性后,作者评估了其清除ROS和抗炎效果。OPNs@LMWH具有良好的生物相容性和低细胞毒性。其显著的细胞内ROS清除能力主要源于增强的细胞摄取效率,而非LMWH的抗氧化性。此外,OPNs@LMWH还能有效抑制促炎细胞因子IL-6和TNF-α的产生。这些结果表明,OPNs@LMWH在逆转氧化应激和炎症方面更为有效。
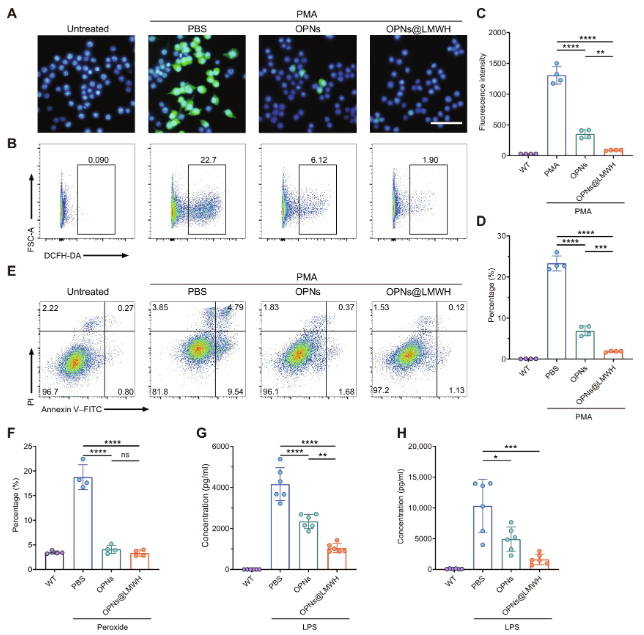
图3. 通过OPNs@LMWH抑制ROS和促炎细胞因子
作者还研究了OPNs@LMWH在缓解小鼠结肠炎症状方面的治疗效果。OPNs@LMWH在小鼠结肠炎模型中显示出良好的生物安全性和显著的治疗效果。与裸OPNs相比,OPNs@LMWH能更有效地保护小鼠免受结肠炎的影响,减少体重减轻、结肠长度缩短和脾脏增大。组织病理学检查显示,OPNs@LMWH治疗后,结肠隐窝结构更完整,溃疡面积减少,显著提高了治疗效果。
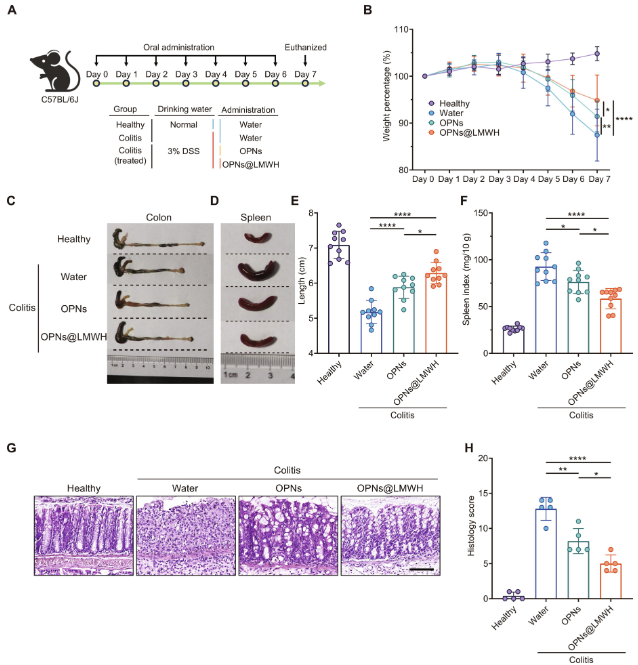
图4. OPNs@LMWH对结肠炎小鼠的治疗效果评价
上述结果表明OPNs@LMWH在UC管理中的潜力。作者通过酶联免疫吸附试验(ELISA)确认,ELISA结果显示,OPNs@LMWH治疗的结肠炎小鼠外周血和固有层中的促炎细胞因子水平较低,免疫调节能力增强。MPO免疫组织化学显示OPNs@LMWH组结肠中氧化应激水平最低,主要在黏膜下层,说明其通过清除ROS精确影响促炎细胞因子的产生。IHC结果表明,OPNs@LMWH治疗减少了JAK-STAT信号通路的激活,表明炎症活性下降。
免疫荧光染色显示,OPNs@LMWH治疗的结肠炎小鼠上皮细胞恢复并排列有序,肠黏膜通透性恢复。CC3标记的凋亡情况表明,未处理的结肠炎小鼠隐窝底部的PCNA标记细胞增殖几乎停止,而OPNs或OPNs@LMWH治疗的小鼠凋亡上皮细胞比例下降,隐窝细胞增殖恢复。PCNA阳性细胞在OPNs@LMWH治疗后主要位于隐窝底部,表明有序的增殖和分化得到保证。综上,OPNs@LMWH通过恢复肠道稳态和保护结肠上皮来缓解UC。
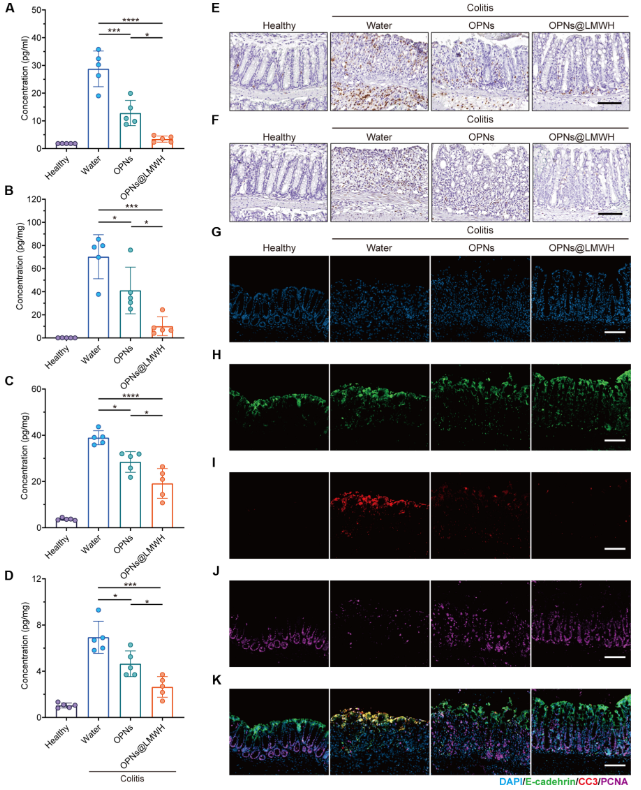
图5. OPNs@LMWH恢复肠道稳态,保护结肠上皮
综上所述,作者的研究为结合LMWH基础的整合素靶向与肠道氧化还原稳态调节的“以一举二”策略提供了强有力的验证,突出了OPNs@LMWH在UC治疗中的应用潜力。更有前景的是,作者的研究强调了通过口服给药使用LMWH作为整合素靶向治疗UC的可行性和灵活性。作者推测,LMWH表面涂层可以普遍应用于各种靶向整合素αM的纳米粒子设计中。这种简单且可调的模块化设计可能激发更多关于自体免疫疾病整合素靶向治疗策略的研究。
原文链接:
https://science.org/doi/10.1126/sciadv.ado7438
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#溃疡性结肠炎# #口服纳米疗法#
97