Nat Immuno: 找到免疫治疗好帮手了!科学家发现,抑制CD36可阻断调节T细胞对肿瘤微环境的适应,增强抗肿瘤活性
2020-03-28 奇点糕 奇点网
阻断CD36还可以和抗PD-1治疗联合使用,进一步增强对肿瘤的杀伤。研究发表在了《自然·免疫学》杂志上。
在免疫系统中,杀伤性T细胞和调节性T细胞是一对背靠背的好搭档,在杀伤性T细胞对病原体和异常细胞大开杀戒的同时,是调节性T细胞保障它不会伤害健康组织。
不过有的时候,调节性T细胞也会兢兢业业地“办坏事”,比如说在肿瘤中。有研究发现,杀伤性T细胞在肿瘤中的浸润会激活一些免疫调节机制,把调节性T细胞也招募到肿瘤中,抑制了自己杀灭癌细胞。
这不就拖后腿了吗?看来,如果能靶向性地抑制肿瘤中的调节性T细胞,说不定能让杀伤性T细胞更好地施展,提高抗肿瘤免疫能力,同时又不影响正常的免疫调节功能?
基于这个思路,瑞士洛桑大学的研究人员开展研究,他们发现,CD36的表达增加是一种重要的代谢响应,让调节性T细胞能适应高乳酸水平的肿瘤微环境,促进了调节性T细胞在肿瘤微环境中的存活和聚集。
通过单克隆抗体等方法阻断CD36后,肿瘤内的浸润的调节性T细胞减少,杀伤性T细胞则明显增加,在不破坏全身的免疫稳态的前提下,抑制肿瘤的生长。不但如此,阻断CD36还可以和抗PD-1治疗联合使用,进一步增强对肿瘤的杀伤。研究发表在了《自然·免疫学》杂志上。
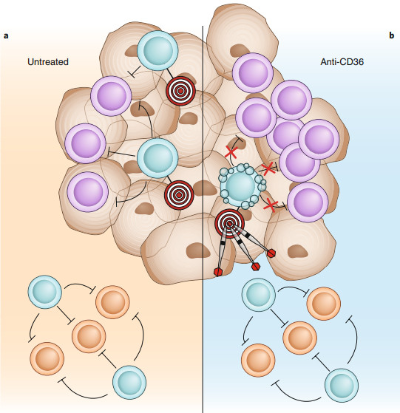
未治疗(a)与CD36单抗治疗(b)的示意图,紫色为杀伤性T细胞,蓝色为调节性T细胞,靶标为CD36,飞镖为CD36单抗
在研究的最开始,为了了解调节性T细胞是如何在肿瘤微环境中安定地生存的,研究人员首先分析了一些乳腺癌患者的调节性T细胞的基因表达特征,并且对比了肿瘤中浸润的和外周循环中的调节性T细胞的差异。
他们发现,两类调节性T细胞的参与脂质代谢的基因表达差异很明显,其中就包括CD36,它调控脂质的摄取,在肿瘤浸润的调节性T细胞中,CD36的表达水平更高。除了乳腺癌患者,研究人员在人肺癌细胞和黑色素瘤细胞体外模型,以及黑色素瘤和肠癌小鼠模型中都发现了这一现象。
在这么多种肿瘤模型中都观察到了CD36表达不同寻常的增加,这肯定不是偶然。因此,接下来,研究人员对CD36表达水平的影响进行了研究。
他们构建了调节性T细胞特异性CD36缺陷型小鼠,和普通小鼠相比,两者全身的免疫稳态性并没有什么差别,效应T细胞和记忆T细胞的比例也是相似的。缺少CD36也不会影响T细胞激活标志物,包括CD44、CD103和杀伤细胞凝集素样受体G1的表达,以及调节性T细胞的标志性分子Foxp3的表达。
唯一的不同是,肿瘤内的调节性T细胞缺少CD36后,细胞表面标志物GITR和OX40表达减少,PD-1、CD25和CTLA-4则没有,表明CD36的表达调节效应调节性T细胞的抑制功能。
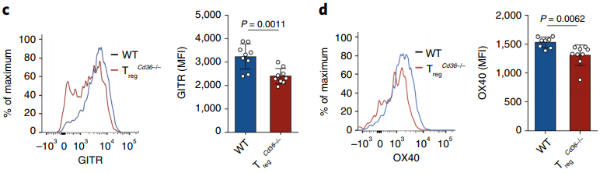
普通小鼠(蓝)和调节性T细胞CD36特异性缺失小鼠(红)GITR(c)和OX40(d)表达水平的对比
另外,肿瘤内促炎细胞因子干扰素-γ(INF-γ)和肿瘤坏死因子(TNF)的水平明显增加,这也说明,CD36抑制了肿瘤内调节性T细胞产生促炎细胞因子的能力,它们是介导免疫反应的重要因子。
这些结果意味着,CD36不是调节性T细胞维持全身免疫稳态的必需分子,它仅是肿瘤内调节性T细胞的抑制功能所必需的。
在实验中,研究人员还发现,CD36的缺失不但影响了肿瘤内调节性T细胞的功能,还减少了它们在肿瘤中的聚集。
荧光染色实验结果显示,CD36缺失并没有影响肿瘤内调节性T细胞的增殖,但是促进了细胞的凋亡。过去的研究发现,线粒体代谢和适应性调节调节性T细胞的抑制功能和生存[3-6],因此,研究人员检查了这些细胞中线粒体的情况。
他们发现,与普通小鼠或者是缺失CD36的外周调节性T细胞相比,缺失CD36的肿瘤内调节性T细胞的线粒体膜电位下降,这一现象已经被证明会在细胞凋亡早期就开始出现。电子显微镜观察也显示,这些细胞中线粒体数量更少,每个线粒体的线粒体嵴也更少(能量需求大的细胞线粒体嵴数量多)。
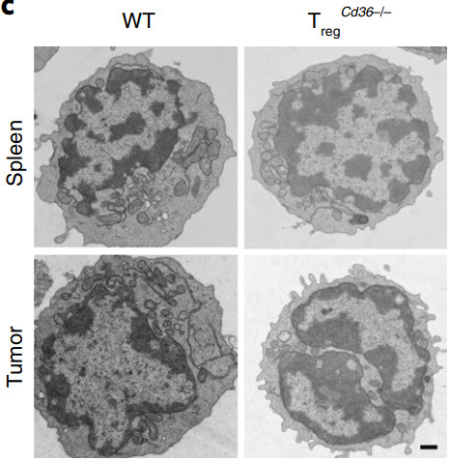
普通小鼠(左)和调节性T细胞CD36缺失小鼠(右)脾脏(上)和肿瘤(下)中的线粒体数量对比
除此之外,细胞的耗氧率降低,糖酵解速率提高,这表明,缺失CD36导致氧化磷酸化受损,细胞的代谢向糖酵解倾斜。
据此,研究人员推测,肿瘤内调节性T细胞的CD36表达增加可能是通过调节线粒体适应性来响应肿瘤微环境,改变了代谢途径,帮助调节性T细胞更好地生存。随后的实验证明了他们的推测。
那么CD36是通过谁来调节这种代谢适应性的改变的呢?对比发现,肿瘤内调节性T细胞的参与PARP通路的基因表达增加,而CD36可以通过线粒体激活因子PARP-β和PARP-γ依赖性的方式增强对线粒体活性的调节,来改变代谢。
经过逐一实验,研究人员将目标锁定在了PARP-β上。PARP-β途径的激活使得肿瘤内调节性T细胞线粒体膜电位增加,凋亡减少,在不缺失CD36的情况下,PARP-β的激活还增强了CD36的表达,进一步提高了肿瘤内调节性T细胞的代谢适应。
最后,研究人员制作了靶向CD36的单克隆抗体,并对黑色素瘤小鼠进行了治疗。肿瘤中调节性T细胞的水平降低,杀伤性T细胞的浸润增加,显着抑制了肿瘤的生长。
另外,肿瘤中杀伤性T细胞的耗竭也是常常出现的问题。因此,单独抑制调节性T细胞可能是不够的,研究人员也尝试了同时使用阻断CD36和PD-1,对肿瘤的杀伤作用果然是“更上一层楼”,也延长了小鼠的生存期。
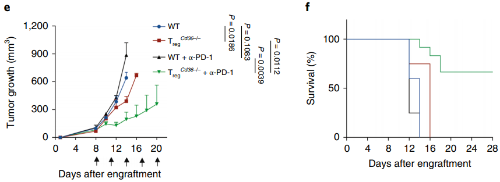
普通小鼠(蓝)、调节性T细胞CD36特异性缺失小鼠(红)、接受PD-1单抗治疗的普通小鼠(黑)和同时阻断CD36和PD-1治疗的小鼠(绿)在肿瘤体积(e)和生存率(f)上的对比
总的来说,这项研究表明,肿瘤中的调节性T细胞在代谢方面异于其他调节性T细胞,使它们能更好地适应肿瘤微环境,并在其中扼制杀伤性T细胞发挥功能,而这一切都是CD36赋予的,靶向抑制它,或许可以成为新的抗癌疗法或是辅助抗癌疗法。
原始出处:Haiping Wang, Fabien Franco, Yao-Chen Tsui, et al. CD36-mediated metabolic adaptation supports regulatory T cell survival and function in tumors. Nat Immuno. 17 February 2020
作者:奇点糕
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#阻断#
42
#肿瘤活性#
48
#调节T细胞#
44
#科学家发现#
41
#抗肿瘤活性#
56