七年较量:一例结肠癌多发转移标准多线长周期病例分享
2024-07-23 肿瘤医学论坛 肿瘤医学论坛
介绍一结肠癌患者的多线治疗经过,包括外院及本院治疗,专家从各专业角度讨论,涉及优化、放疗、全程管理等,患者最终去世。
01 病例介绍
患者基本情况
患者:男,69岁
主诉:腹痛2天
现病史:患者于2015年10月因“腹痛2天”考虑“升结肠癌并穿孔”在外院行右半结肠切除术+腹腔冲洗置管引流术,术后病理回报:1、(右半结肠)中分化腺癌,侵及浆膜层;(上、下切缘及阑尾)未见癌;自检肠旁淋巴结未见转移性癌(0/3);2、(右半结肠)穿孔。免疫组化结果:MSH2(+),MSH6(+),MLH1(+),PMS2(+)。
既往史:否认慢性肝炎、肝病病史。否认恶性肿瘤家族史。
术后体格检查:PS评分1分。神清,皮肤巩膜无明显黄染。浅表淋巴结无触及肿大。腹平软,无压痛、反跳痛,肝脾肋下未触及,全腹未触及肿物,移动性浊音阴性,听诊肠鸣音正常。
初步诊断:右半结肠中分化腺癌pT3N0M0 IIA期 pMMR
外院治疗经过
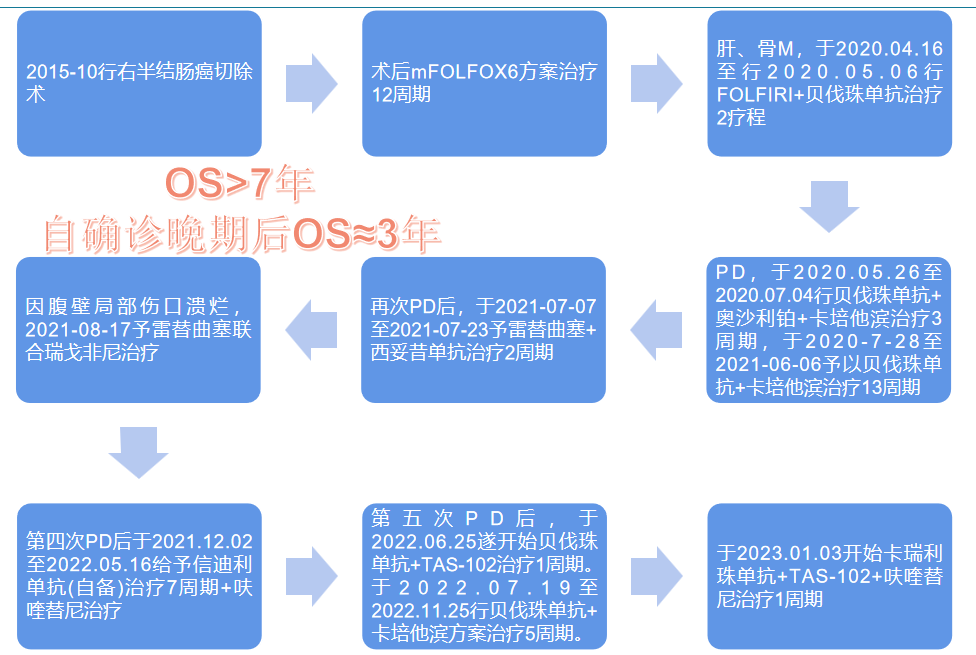
术后辅助治疗:mFOLFOX6方案治疗12周期。
定期复查:
2020.04.01腹部彩超示:肝内实性团块,考虑转移性Ca可能性大。
2020.04.13胸部及肝脏CT平扫+增强示:1、右肺下叶及左肺上叶、下叶可见多发结节,性质待定。2、肝右叶低密度灶考虑肝转移瘤可能性大。
全身骨显像示:右侧第10后肋和L5椎体异常浓聚灶,不除外骨转移瘤。
基因检测结果:KRAS、NRAS、BRAF野生型,PD-L1中表达(具体不详)。
晚期一线(外院):
于2020.04.16至2020.05.06行FOLFIRI+贝伐珠单抗治疗2疗程。
晚期二线(外院):
治疗后出现肝右叶新发低密度灶,考虑肝转移瘤可能性大。
于2020.05.26至2020.07.04行贝伐珠单抗+奥沙利铂+卡培他滨治疗3周期副作用:输注奥沙利铂(第3周期)过程中出现喉头水肿、呼吸困难、躯干及四肢皮肤发红,予以立即停止药物使用,吸氧,地塞米松等处理后患者缓解。
3周期后复查CT疗效评价PR(具体不详)。
于2020.07.28至2021.06.06予以贝伐珠单抗500mg+卡培他滨1.5 bid d1-14治疗13周期。
晚期三线(外院):
2021.07.03复查影像学提示疾病进展。
患者拒绝行基因检测。
于2021.07.07至2021.07.23予雷替曲塞5mg+西妥昔单抗900mg治疗2周期。(2020.04基因检测:KRAS、NRAS、BRAF野生型)
于2021.08.01出现恶心、呕吐,就诊于外院。
外院CT:2021.08.01上下腹CT平扫:1、结肠癌术后改变,术区未见明确复发征象:腹膜后肿大淋巴结,同前,考虑淋巴结转移。2、空肠不全性梗阻,梗阻点位于空肠远端,多为粘连性梗阻。3、肝右前叶上段混杂密度结节,较前变化不大。疗效评价SD。
肝穿刺活组织检查:
于2021.08.06行肝穿刺活检术。
病理回报:(肝S8段低回声区)腺癌,CDX2(+)、CK7(-)、CK20(+)、Hepa(-)、TTF-1(-)、HER-2(-),免疫表型提示为胃肠道来源。免疫组化结果:MSH2(+),MSH6(+),MLH1(+),PMS2(+)。
后续治疗(外院):
考虑患者为肠癌三线治疗后,合并不全性肠梗阻,局部伤口溃烂,考虑使用西妥昔单抗副反应。
2021.08.17予雷替曲塞5mg化疗,联合瑞戈非尼靶向治疗。
患者因口服瑞戈非尼不良反应(II度手足综合征)拒绝继续用药。
外院治疗经过小结
本院治疗经过
患者于2021.11.24就诊于我院。
患者诉下腹部疼痛,无恶心、呕吐。
PS评分1分,疼痛NRS评分2分。
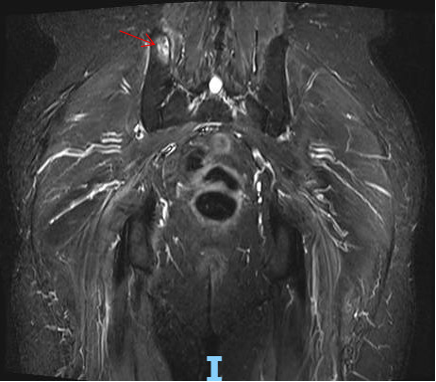
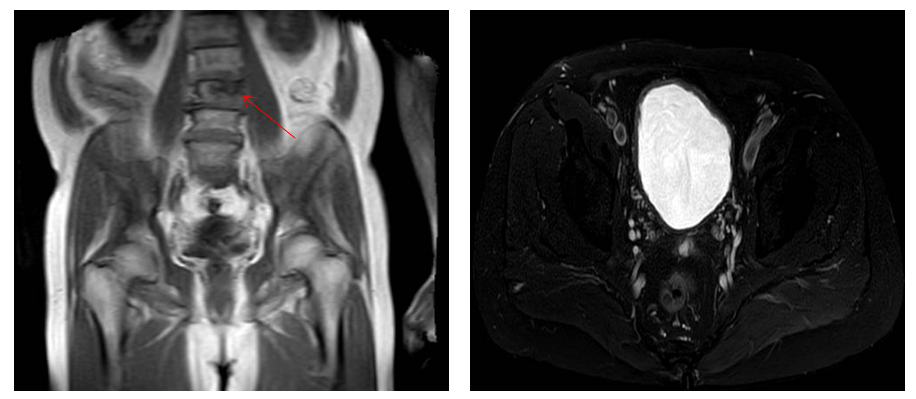
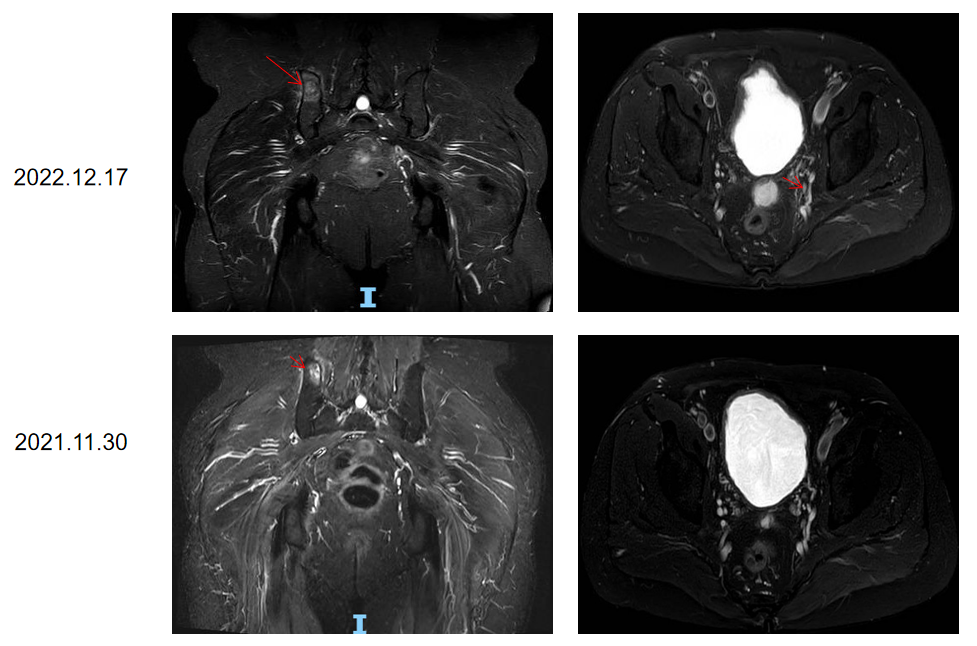
2021.11.30 MR提示:所示右侧髂骨见斑片状长T2信号影(8-19),大小约2.3cm×1.2cm。考虑转移瘤。
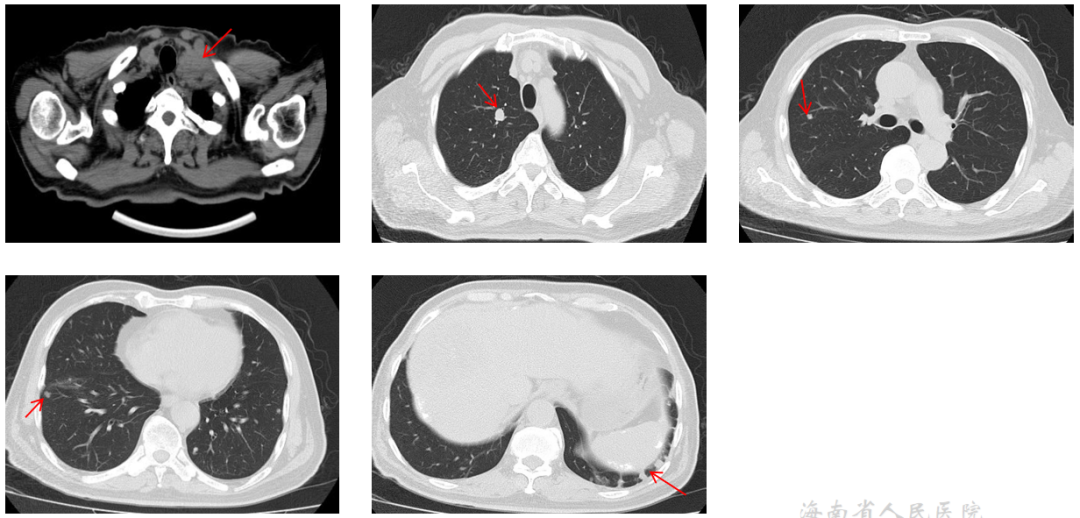
2021.12.02 CT:左侧颈部多发淋巴结肿大,考虑转移。双肺多发结节,考虑转移瘤。
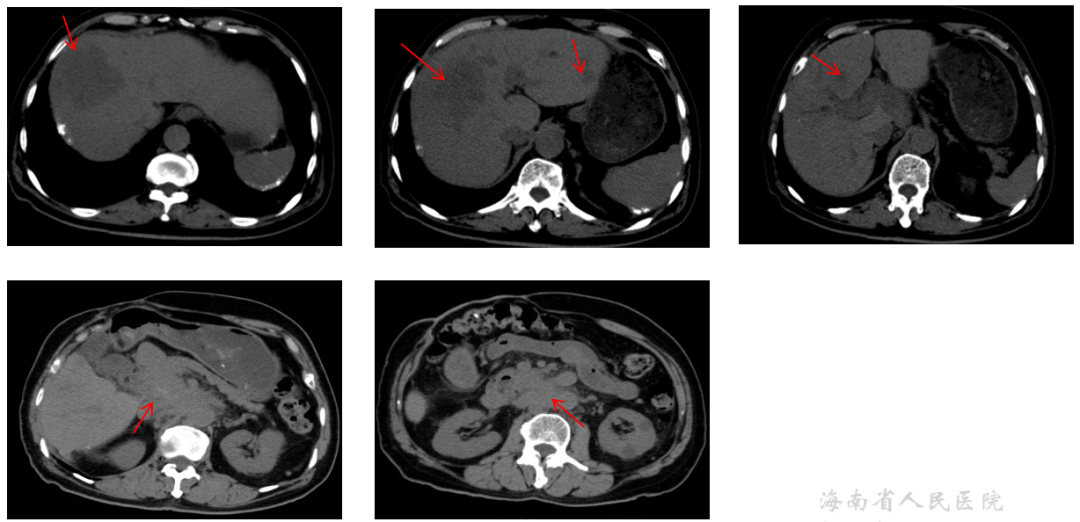
2021.12.02 CT:肝内多发低密度灶,考虑转移。肝门区及腹膜后多发肿大淋巴结,包绕胰头。
诊断:升结肠癌术后化疗后复发(肝、肺、骨转移)IVB期多线治疗后 KRAS、NRAS、BRAF野生型 HER-2阴性 pMMR
第一次MDT
MDT意见:肿瘤晚期,多程治疗后进展。肝、肺、腹膜后淋巴结、骨转移,为广泛转移。
治疗目的:姑息治疗。
治疗策略:系统性抗肿瘤治疗。
治疗目标:改善生活质量、延长生存期。
治疗建议:建议患者再次基因检测(包括RAS、BRAF、HER-2、NTRK、MSI等基因),患者拒绝。
四线治疗:
于2021.12.02至2022.05.16给予信迪利单抗200mg d0(自备)治疗7周期+呋喹替尼3mg qd d1-21;21天为1周期治疗,并唑来膦酸抑制。
复查:
患者于2022.06.15返院,
PS评分1分,疼痛NRS评分2分。
CEA:5.34ng/ml。
2022.06.17 CT:双肺散在结节,考虑转移瘤。左侧颈部多发淋巴结肿大,考虑转移。
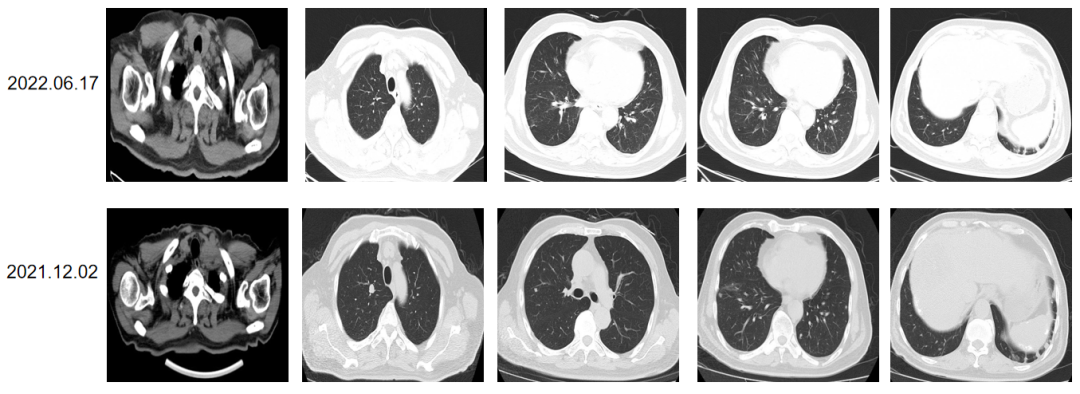
2022.06.17 CT:肝内多发低密度灶,大者大小约3.2X3.0cm,较前略缩小,考虑转移。肝门区及腹膜后多发肿大淋巴结(大者约2.4×3.2cm),较前无明显变化,包绕胰头。
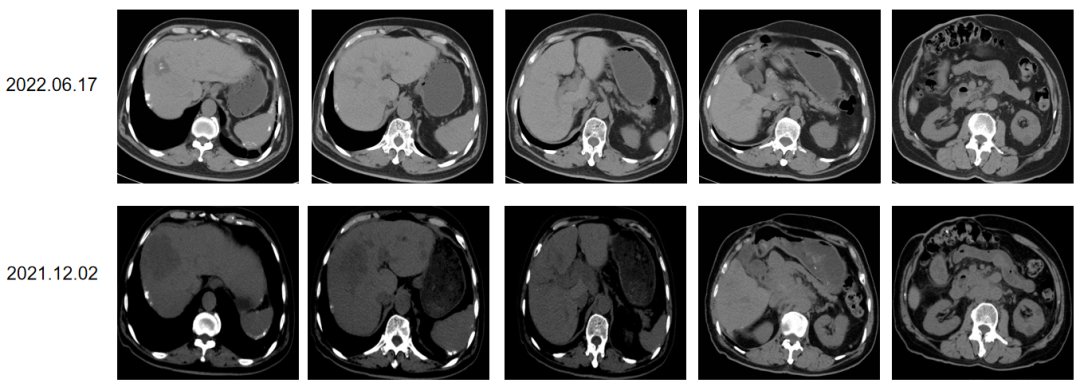
2022.06.17 MR:对比2022-03-15日片:右侧髂骨异常信号,较前相仿。膀胱直肠间隙淋巴结肿大1.0cm(新)。腰4椎体骨质破坏(新),考虑转移。
五线治疗:
疗效评价PD。(PFS 6+m)
于2022.06.25开始贝伐珠单抗+TAS-102治疗1周期。
副作用:患者出现大便次数增多,每日10余次,恶心、呕吐。
2022.07.13上腹部CT:肝内多发低密度灶,较前略缩小。患者因经济原因停用TAS-102治疗,要求使用卡培他滨。
于2022.07.19至2022.11.25行贝伐珠单抗7.5mg/kg+卡培他滨1250mg/m2 bid d1-14;21天为1周期方案治疗5周期(继续唑来膦酸抑制骨破坏)。
复查:
PS评分1分,疼痛NRS评分2分。
CEA:87ng/ml。
2022.12.17 CT:对比2022.10.27上下腹片、2022.06.17胸部:肝内多发低密度灶,大者大小约1.7x1.5cm,其内见条状稍高密度影,较前缩小,考虑转移。肝门区及腹膜后多发肿大淋巴结(大者约2.7×2.6cm),部分包绕胰头。右侧髂骨高密度灶,转移瘤不除外。双肺散在结节(直径约0.7cm),较前相仿,考虑转移瘤。所示左侧颈部多发淋巴结肿大(大小约1.8x1.2cm),较前相仿,考虑转移。
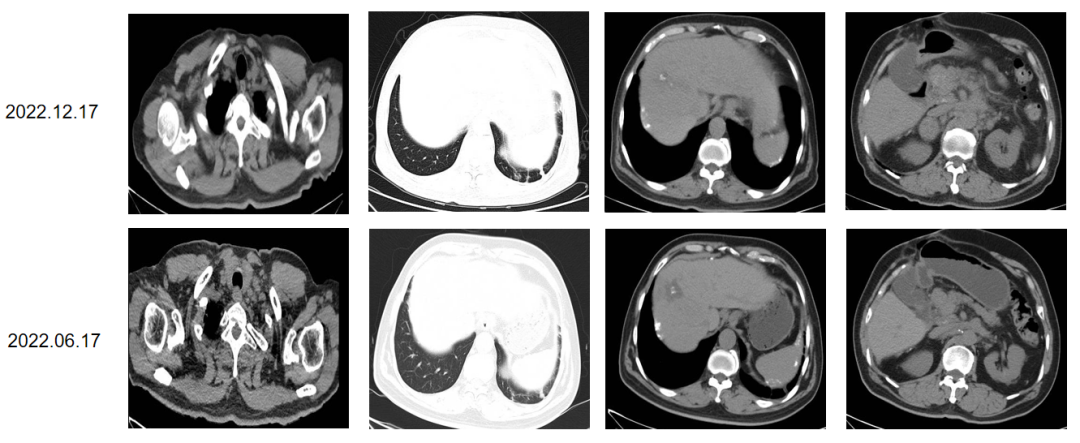
2022.12.17 MR:对比2022.06.17 MRI:右侧髂骨异常信号范围较前增大,多考虑转移瘤。膀胱直肠间隙肿大淋巴结较前明显增大2.4cm,请结合临床。腰4椎体骨质破坏考虑转移。
第二次MDT
疗效评价SD。
MDT讨论意见:患者肝、肺、多发淋巴结转移控制(缩小的SD),目前右侧髂骨异常信号范围较前增大,膀胱直肠间隙肿大淋巴结较前明显增大,可考虑联合局部放射治疗+原方案治疗。
因放射治疗等待期长,且患者及家属不同意局部治疗。
患者及家属要求更换治疗方案。
于2023.01.03开始卡瑞利珠单抗200mg d1+TAS-102 30mg/m2 bid d1-5,d8-d12;28天为1周期+呋喹替尼3mg qd d1-21;28天为1周期治疗1周期。
患者渐出现皮肤黏膜黄染,外院检查提示:TBIL:77.4umol/L,DBIL:51.3umol/L,ALT:62.4U/L,AST:108.4U/L(2023.01.29)。
2023.02.11 MRI检查(新1.5T):上腹部(肝胆脾)(平扫):肝内多发结节及肿块影,考虑肿瘤性病变,转移瘤可能,建议增强扫描。肝门区、腹腔及腹膜后多发肿大淋巴结。胆囊体积增大,壁稍增厚,考虑胆囊炎。腹水,腹膜炎。
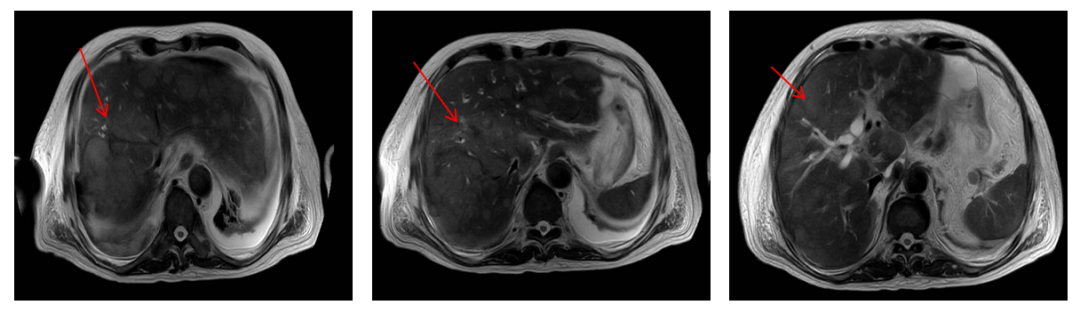
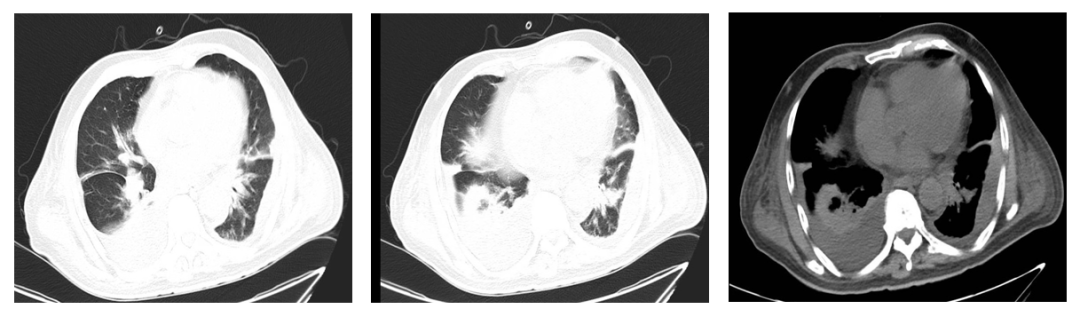
2023.02.13 CT检查:胸部(平扫):与2022-12-20对比:双肺散在结节(202-54,直径约0.8cm),较前稍增大,增多,考虑转移瘤。双肺多发渗出/感染性病变,较前增多,建议治疗后复查。(新)胸腹壁软组织肿胀。(新)所示左侧颈部多发淋巴结肿大(201-5,大小约1.8x1.2cm),较前相仿,考虑转移。右侧心膈角区淋巴结肿大,短径直径约1.5cm,较前增多、增大。肝脏体积增大,肝内多发低密度灶,边界不清,其内见条状稍高密度影,考虑转移,建议结合腹部检查。肝内胆管扩张。(新)
治疗经过小结
于2023.02.08行超声引导下经皮腹腔积液置管引流术,于2023.02.14行PTCD引流,抗感染,护肝降酶退黄治疗,白蛋白、血浆等支持治疗,患者氧分压下降,患者转氨酶、胆红素指标进行性升高,患者因肝转移、肝衰竭、呼吸功能衰竭、心功能衰竭而亡。
去世时间:2023.02.25。
02 病例讨论
问题 1:请根据您的专业谈谈该病例的整个治疗过程,有什么可以优化的地方?
昆明医科大学附属第一医院-肿瘤外科-周锐泽:这位患者病情确实复杂。2015年患者因右半结肠穿孔需手术,病理显示ⅡA期。术后,进行了12周期的mFOLFOX6辅助化疗,治疗规范。2020年4月,肿瘤复发,出现转移,当时患者的NGS检测结果为KRAS、NRAS、BRAF野生型,但在整个病例治疗中只用了两个周期的西妥昔单抗,不管是后线出现肝脏、肺、骨转移及腹膜淋巴结转移的情况,也一直在用贝伐珠单抗。依我看,如果出现疾病进展的情况,是否可以把西妥昔单抗重新结合,再尝试使用?虽然这一部分治疗是在外院进行的。2021年就诊杨教授团队后,虽然有疾病进展,但进行了规范的MDT讨论,制定了详细的治疗计划。尽管患者最终因多器官功能衰竭去世,但其生存期长达7年,其中晚期OS获得了3年的存活时间,这得益于杨教授团队的全程管理。
昆明医科大学附属第一医院-肿瘤内科-邓俊:杨教授分享的病例让我深受震撼,全程管理、个体化治疗以及多学科团队的协同作用彰显了医疗的魅力。在我看来,患者从二线至后线治疗,药物其实也是物尽其用了。2023年1月,患者开始使用卡瑞利珠单抗加TAS-102和呋喹替尼的治疗,可能引发了超进展。就我自己的临床经验来看,如果使用免疫治疗,需要评估超进展的高危因素,如年龄和PS评分。一般来说,对于PS评分低的患者,我们会比较慎重使用免疫治疗,一是因为可能得不到理想的获益效果,二是存在超进展风险。
昆明医科大学附属第一医院-放疗科-汪勇:杨教授的病例展示了真实世界治疗的复杂性和挑战。患者经历了各种治疗手段,尝试了各种药物。“幸福”组合在MSS患者中的应用其实也取得了不错的效果。在治疗过程中,患者肺部病灶甚至略有缩小。当然,以我们目前的临床经验来看,MSS患者从免疫治疗中获益的概率不高,但多项研究也显示,抗血管生成药物联合免疫治疗和放疗,在结直肠癌MSS患者中也能够取得一个比较好的病理完全缓解率。对于这个患者,我认为在西妥昔单抗的使用上是有遗憾的,不管是不良反应太大或者是其他的一些副反应,我认为也可以尝试减量以后再挑战,或者使用类似药物,比如鼻咽癌的尼妥珠单抗,应用在这个患者中是不是可以取得相对更好一点的缩瘤效果?我觉得这是值得去探讨的。当然,国内一些类似物,比如西妥昔单抗的类似物会不会在不良反应方面更小一点?也值得我们进一步观察。
昆明医科大学附属第一医院-医学影像科-彭超:首先,患者是以急腹症的情况入院,但只做了CT平扫,建议对急腹症患者进行增强CT扫描,以更全面、更准确评估原发疾病的病变。其次,听杨教授说患者拒绝增强检查,那么在CT平扫的情况下如果是病灶明显增大以及明显增多,可以判定为病变是进展的。但如果只是体积稍微增大,在疗效的评价上可能就不是那么准确。在这种情况下,我建议用磁共振,磁共振除了平扫以外可以加扫功能序列比如说DWI, DWI比CT平扫和磁共振平扫更具敏感性。所以,在治疗过程中如果患者拒绝增强的话,那我们可以用磁共振的平扫加DWI对病变进行比平扫更精确的疗效评估。
昆明医科大学附属第一医院-病理科-薛凤麟:杨教授提供的这份病例中,患者的治疗过程是比较坎坷的。该患者自2015年被诊断为肠癌,经历了一系列复杂的治疗过程,直至2023年去世。尽管病情曲折,患者有幸接受了规范的治疗,延长了生存期。
肠癌作为一种常见的恶性肿瘤,其组织学分型多样。组织学分级则根据腺管形成的比例,分为高分化、中分化和低分化腺癌。有点遗憾,没看到这个患者的病理学图片,但根据描述推测,患者可能是中分化腺癌。病理报告除了反映肿瘤的组织学分级和分型,同时还需报告肿瘤的浸润深度、脉管浸润情况、切缘情况及肠周淋巴结转移等情况。为了确保病理的TNM分期准确性,一般要求肠周的淋巴结要能够至少检出12 枚。这位患者可能由于一些现实的问题,淋巴结可能确实肉眼比较难检出,淋巴结数量不足12枚,我觉得可能需要引起临床的重视,提醒病理科必要情况下再补取材,同时还需要报告它是否有肠周的癌结节形成,是否有肿瘤的出芽现象也需要在病理报告中得以体现,因为2020年的CSCO指南提到肿瘤出芽是Ⅱ期结肠癌独立的预后的因素。
患者在治疗过程中进行了基因检测,NRAS、KRAS和BRAF结果均为野生型,而PD-L1检测结果不明确。患者还通过免疫组织化学检测了错配修复蛋白,四项结果均为阳性。建议在可能的情况下,动员患者进行2B3D-MSI的分子检测。蛋白水平显示MSI未缺失,但有些情况下分子检测结果可能与免疫组织化学结果不完全一致。总体来看,患者的病理诊断较为明确,但由于患者自身原因,有些分子检测未进行,也是有点遗憾。
问题2:针对该病例,是否考虑在病程中适时加入放疗,例如针对骨转移或肝的问题,以优化治疗效果?
昆明医科大学附属第一医院-放疗科-汪勇:我认为可以,因为放疗与免疫治疗具有协同作用。有些医院可能会做一些空间放疗,即在常规放疗的照射区域内给予高分割剂量,不会带来特别大的不良反应,但是可以释放足够多的抗原引起免疫治疗疗效的增加。目前有很多小样本的研究正在进行,希望将来能够取得一个很好阳性结果。
03 MDT小结
该病例是一位64岁的晚期结直肠癌患者,在2010年行结肠癌根治术,2021年复发肝转移。当时,经过MDT讨论,患者被诊断为初治潜在可切除,分子分型显示为RAS和BRAF基因野生型。通过西妥昔单抗联合双药化疗的转化治疗,患者达到了显著的疗效。值得称赞的是,该病例在关键治疗节点均有MDT团队的参与。
该病例患者是一位老年男性,患有右半结肠癌。手术后,他接受了辅助化疗。不幸的是,化疗后不久,出现了多发转移。尽管面临挑战,患者经历了二线、三线乃至四线、五线、六线的治疗,包括化疗、免疫治疗、靶向治疗等。令人鼓舞的是,患者获得了超过7年的生存期。这得益于杨教授及MTD 团队制定的治疗计划,他们采取稳扎稳打、步步为营的策略,确保了病情的稳定,延长了患者的生存期。
述评
唐山中心医院-肿瘤内科-刘卫东:对于这位患者,我感觉有点遗憾的是在出现骨转移的时候,放射治疗没有及时用上。我觉得对多发转移的处理也要加上放射治疗,一是因为控制病情非常快,二是放疗增免。另外我还是感觉这个病例的病情评估方面有点不是很准确。
这个病例治疗的紧凑性或者是治疗节奏上,我认为可以更明确一些。比如说手术以后的辅助,辅助以后复发的一线治疗,如果一线稳定的话,是不是还有个维持治疗,维持治疗接着进展以后有二线治疗,二线治疗以后稳定下来还可以有维持治疗,维持治疗再进展以后还有三线治疗。是不是让患者该治疗的时候能得到一个明确的诱导治疗,如果稳定以后能让患者节奏慢下来,得到一个休息,休息后有问题的话再进一步处理,这样患者是不是生活质量会高一点?另外,该病例始终没提到患者的一般状况的情况,比如说患者后期是不是出现贫血、低蛋白等情况,当然也有可能因为篇幅和时间等原因杨教授没有展示出来。
我认为在肿瘤治疗过程中,要强调全程管理,要强调改善患者的一般状况。只有在这种情况下,才能保证患者得到更规范的治疗,生活质量得到提高。
总而言之,全程管理是比较重要的。除此之外,还有个可圈可点的地方,就是杨教授团队接到这个患者以后对病情评估做了一个明确的MDT讨论,给出明确的治疗方向,治疗还是很规范的。我觉得这个患者能得到7年多的长生存,与这种规范的治疗和全程管理密切相关。
作者:肿瘤医学论坛
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#结肠癌# #肝转移#
87