【指南与共识】| 基于中国人群的BRCA胚系突变筛查专家共识(2024年版)
2024-04-06 中国癌症杂志 中国癌症杂志
以期为中国人群的BRCA胚系突变筛查提供证据借鉴和规范依据,并为后续的相关指南制订奠定基础。
[摘要] BRCA基因(包括BRCA1和BRCA2)的胚系突变是家族性乳腺癌、卵巢癌等肿瘤的核心风险因素。在人群中,特别是已有肿瘤家族史的高危人群中,BRCA基因检测可以发挥预防性管理作用,有助于降低此类遗传性疾病的死亡率和社会危害。近年来基于二代测序技术的BRCA胚系突变检测方案逐步落地,检测可及性不断增强。为了进一步规范相关检测工作,完善中国人群中胚系突变筛查的工作流程,本共识制定小组依托中国抗癌协会肿瘤标志物专业委员会和上海市抗癌协会肿瘤标志物专业委员会,采用循证医学方法,在文献检索的基础上,对目前在人群中开展BRCA胚系突变检测过程中所共同关注的筛查开展场景、技术方案、质量控制、结果解读与报告、遗传咨询等热点问题形成带有质量等级评价、证据综合的初步推荐意见,并采用多学科专家讨论、德尔菲问卷调查等形式,对专家意见进行调查汇总、归纳梳理和反复修改,最后形成了《基于中国人群的BRCA胚系突变筛查专家共识(2024年版)》,以期为中国人群的BRCA胚系突变筛查提供证据借鉴和规范依据,并为后续的相关指南制订奠定基础。
[关键词] 专家共识;BRCA1;BRCA2;同源重组;突变筛查;二代测序;胚系突变
[Abstract] Germline mutations in BRCA genes (including BRCA1/2) are the major risk factors for hereditary tumors including breast and ovarian cancer. Population based BRCA gene screening, particularly in high-risk individuals with a family history of cancer, can play a preventive role by reducing mortality and societal impact of these genetic diseases. Recent years have witnessed the increasing accessibility of BRCA germline mutation testing based on next generation sequencing technology. To further standardize the workflow for BRCA germline mutation screening in the Chinese population, a consensus development group was established by the China Anti-Cancer Association Tumor Biomarker Professional Committee and the Shanghai Anti-Cancer Association Tumor Biomarker Professional Committee. Using an evidence-based approach and building upon literature reviews, the group formulated preliminary recommendations with quality assessments and evidence synthesis regarding common concerns in the process of BRCA germline testing in the population, including screening scenarios, technical approaches, quality control, result interpretation and reporting, as well as genetic counseling. Through multidisciplinary discussions and Delphi questionnaire survey "expert consensus on population-based BRCA germline mutation screening in China (2024 edition)" was developed after summarization and revision. This consensus aims to provide evidence-based guidance and regulatory foundations for BRCA germline mutation screening in the Chinese population and lay the groundwork for further guideline development.
[Key words] Expert consensus; BRCA1; BRCA2; Homologous recombination; Mutation screening; Next-generation sequencing; Germline mutation
《基于中国人群的BRCA胚系突变筛查专家共识(2024年版)》
专家组
执笔专家名单
-
吴之源 | 复旦大学附属华山医院检验科
-
姜惠琴 | 复旦大学附属中山医院检验科
-
张 丽 | 复旦大学附属中山医院检验科
-
王砚春 | 复旦大学附属肿瘤医院检验科
-
张卿芸 | 复旦大学附属华山医院中心实验室
-
王小钦 | 复旦大学附属华山医院血液科
-
王 兵 | 复旦大学附属华山医院健康管理中心
-
江孙芳 | 复旦大学附属中山医院健康管理中心
-
郭 林 | 复旦大学附属肿瘤医院检验科
-
郑 慧 | 复旦大学附属肿瘤医院检验科
-
马晓路 | 复旦大学附属肿瘤医院检验科
-
谢素红 | 复旦大学附属肿瘤医院检验科
-
卢仁泉 | 复旦大学附属肿瘤医院检验科
-
郭 玮 | 复旦大学附属中山医院检验科
-
关 明 | 复旦大学附属华山医院检验科
咨询与调研专家名单
(按姓氏笔画排序)
-
于文强 | 复旦大学生物医学研究院
-
于津浦 | 天津医科大学肿瘤医院肿瘤分子诊断中心
-
王书奎 | 南京医科大学附属南京医院医学检验科
-
王佳谊 | 上海市胸科医院检验科
-
王保龙 | 中国科技大学附属第一医院检验科
-
王 辉 | 北京大学人民医院检验科
-
史庭燕 | 复旦大学附属中山医院妇科肿瘤科
-
邢金良 | 空军军医大学基础医学院
-
任 丽 | 天津医科大学肿瘤医院检验科
-
刘焕亮 | 中山大学附属第六医院检验科
-
江一舟 | 复旦大学附属肿瘤医院乳腺外科
-
江赐忠 | 同济大学生命科学与技术学院
-
许青霞 | 河南省肿瘤医院检验科
-
许颂宵 | 中国科学院大学附属肿瘤医院检验科
-
纪爱芳 | 长治医学院附属和平医院检验科
-
杜鲁涛 | 山东大学齐鲁医院检验医学中心
-
李 冬 | 同济大学附属同济医院检验科
-
李海霞 | 北京大学第一医院检验科
-
李悦国 | 天津医科大学肿瘤医院检验科
-
杨慧娟 | 复旦大学附属肿瘤医院妇瘤科
-
吴小华 | 复旦大学附属肿瘤医院妇瘤科
-
何帮顺 | 南京市第一医院医学检验科
-
应斌武 | 四川大学华西医院实验医学科
-
张 义 | 山东大学齐鲁医院检验医学中心
-
陆劲松 | 上海交通大学医学院附属仁济医院乳腺外科
-
陈维贤 | 重庆医科大学附属第二医院检验科
-
陈 葳 | 西安交通大学医学院第一附属医院实验医学中心
-
邵志敏 | 复旦大学附属肿瘤医院乳腺外科
-
欧阳能太 | 中山大学孙逸仙纪念医院细胞分子诊断中心
-
欧启水 | 福建医科大学附属第一医院检验科
-
郑 磊 | 南方医科大学南方医院检验科
-
周 敬 | 复旦大学附属中山医院健康管理中心
-
胡 欣 | 复旦大学附属肿瘤医院精准肿瘤中心
-
胡 敏 | 中南大学湘雅二医院检验科
-
柳光宇 | 复旦大学附属肿瘤医院乳腺外科
-
娄加陶 | 上海交通大学医学院附属第一人民医院检验科
-
倪 明 | 复旦大学附属肿瘤医院杂志社办公室
-
秦东春 | 郑州大学第一附属医院检验科
-
耿 燕 | 西安交通大学第二附属医院检验科
-
徐笑红 | 浙江省肿瘤医院检验科
-
梁晓华 | 复旦大学附属华山医院肿瘤科
-
蒋 黎 | 四川省医学科学院•四川省人民医院检验科
-
温 灏 | 复旦大学附属肿瘤医院妇瘤科
-
颜宏利 | 海军军医大学附属长海医院实验诊断科
BRCA基因包括BRCA1和BRCA2,可编码DNA同源重组过程中的关键功能蛋白,是维持人体基因组稳定性的核心基因[1]。目前已经确认BRCA基因存在大量致病性的胚系突变,并与多种肿瘤,特别是家族性乳腺癌和卵巢癌,以及胰腺癌、前列腺癌、黑色素瘤的发生风险存在密切关联[2]。相较于在肿瘤患者中进行BRCA基因突变检测的“诊断性”作用;在人群中,尤其是已有肿瘤家族史的高危人群中,BRCA基因检测可以发挥“预防性管理”作用,有助于降低此类特殊遗传性疾病的死亡率和社会影响;从成本效益上看,将筛查扩展到健康的家庭成员还可以节省与这些疾病相关的诊疗费用。对于年轻且具有乳腺癌或卵巢癌家族史的个体进行BRCA1和BRCA2基因突变的筛查以及早期预防、干预已被证明可有效降低相关肿瘤的发生及致死风险[3]。因此,对具有潜在肿瘤风险的人群进行BRCA胚系突变筛查是预防和早期发现癌症的重要措施。
近5年来,我国已先后针对肿瘤患者的BRCA基因检测、数据解读、个体化治疗方案选择形成了一系列的指南与共识[4-6],为检测指征、检测方式及检测结果解读提供了明确参考。然而在人群中进行BRCA胚系突变筛查的工作尚处于起步阶段[7]。近年来检测成本的不断下降、试剂盒的获批入市,虽然大幅提高了BRCA胚系突变筛查的可及性,但也对相关检测工作提出了更高的规范化及标准化要求。
本共识以中国抗癌协会肿瘤标志物专业委员会和上海市抗癌协会肿瘤标志物专业委员会为依托,邀请来自全国不同大学、医院的专家共同参与制定,针对筛查人群、筛查时机、实验操作、结果解读及遗传咨询的伦理等问题进行了总结梳理。通过系统文献检索,基于循证医学证据,采用德尔菲问卷调查法,拟定了14条推荐意见及相关推荐说明,以期为人群中的BRCA突变检测提供更加量化和精准的指导,从而提高实践的规范化和标准化水平。
本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册号为PREPARE-2023CN740。
1 共识的制定方法
1.1 共识专家构成
依托中国抗癌协会肿瘤标志物专业委员会和上海市抗癌协会肿瘤标志物专业委员会,由复旦大学附属华山医院、复旦大学附属中山医院、复旦大学附属肿瘤医院的13名专家成立共识制定小组。共有45名来自上海市、广东省、陕西省、北京市、河南省、江苏省、山东省、四川省、天津市、浙江省、安徽省、福建省、湖南省、山西省、重庆市共15个不同省市的专家参与问卷咨询与调研。共识制定小组及咨询与调研专家组成员涵盖检验医学科、病理科、分子诊断中心、乳腺外科、肿瘤妇科、肿瘤内科、健康管理中心、肿瘤基础研究、图书信息学、临床流行病学及循证医学等领域的多学科专家。
1.2 临床问题遴选
通过系统检索国内外BRCA突变检测的人群筛查及临床应用领域已发表的指南、系统性综述和相关研究,以及对参与遗传性肿瘤人群筛查管理、临床分子诊断及治疗工作的公共卫生、临床检验及临床医学专家的访谈,共识制定小组工作组初步拟定了针对筛查人群、筛查时机、实验操作、结果解读、遗传咨询的伦理及检测样品数据保存共6大类关键问题框架,以在线问卷的形式对临床问题的重要性进行调研和评分。通过收集汇总2轮共32人次(第1轮12人次、第2轮20人次)专家函评反馈,最终遴选出本共识拟解决的14个临床问题。
1.3 文献检索方式及质量评价
检索的英文数据库为PubMed和Embase,中文数据库包括中国生物医学文献数据库、中国知网和万方数据库,检索时限起始于1990年1月,截至2023年8月,英文文献检索词主要包括BRCA1/2、hereditary breast cancer、hereditary ovarian cancer、germline mutation、screening test、population screening、BRCA screening、cancer risk assessment、cancer susceptibility、genome sequencing、variant classification、genetic counseling、quality assurance、practice guideline;中文文献检索词主要包括乳腺癌易感基因、遗传性肿瘤、基因检测、肿瘤风险管理、二代测序、基因筛查、质量保证、致病性解读、突变报告。文献纳入标准为:报道BRCA基因胚系突变在肿瘤患者或人群中随机对照试验、队列研究、病例对照研究等,或涉及BRCA基因胚系突变检测指导临床或人群肿瘤风险评估、健康管理及个体化治疗的指南、共识与综述。文献排除标准为:非英语或汉语发表、学位论文、无法获取全文的文献及重复文献。通过筛选文献及证据总结,起草“推荐意见”。
本共识采用2011年版牛津循证医学中心临床证据等级(Oxford Centre for Evidence-Based Medicine Levels of Evidence,OCEBM)系统[8]进行证据评价,将收集到的证据分为1、2、3、 4、5共5个级别(表1)。
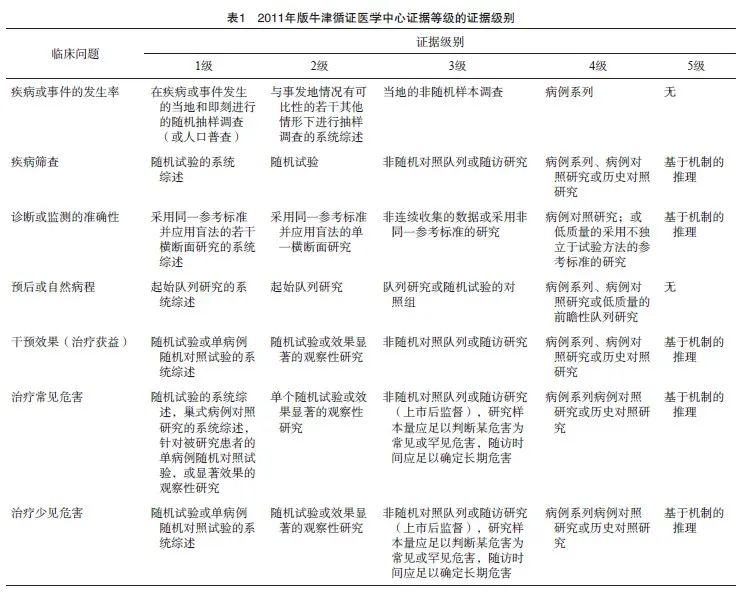
1.4 共识意见形成办法
采用德尔菲问卷调查法就中国健康人群BRCA胚系突变筛查相关“推荐意见”进行专家函询,并征求是否同意的投票意见。专家可对每条“推荐意见”提出修改意见。每次调查结束后,根据专家的反馈意见对“推荐意见”进行修改或增补。目前德尔菲问卷调查法并无统一标准化的赞同水平,参考Hassett等[9]的共识形成方法,若同意率(即选择“非常同意”或“同意” 的专家人数比例)≥75%则认为该条“推荐意见”达成共识。对于证据等级≤3级,且专家同意率≥90%的推荐意见,其推荐强度为A(强推荐);对于证据等级≤3级,且专家同意率达到75%至90%的推荐意见、以及证据等级>3级,且专家同意率≥90%的推荐意见,其推荐强度为B(普通推荐);对证据等级>3级,且专家同意率达到75%至90%的推荐意见,其推荐强度为C(谨慎推荐)。
1.5 共识的目标人群与使用人群
本共识的目标人群为计划进行BRCA胚系突变筛查的个体,使用人群为从事BRCA突变筛查的遗传咨询、临床检测及风险人群管理相关医务工作者。
1.6 共识的传播、实施和更新
共识发布之后,团队将通过多种策略扩大其影响力:① 在学术杂志上予以发布;② 在学术会议上进行解读;③ 利用公众号等数字化平台强化普及度;④ 在中国部分省、自治区、直辖市组织本共识推广会议,确保相关医疗人员和被筛查对象对BRCA胚系突变筛查有准确的认知并能得到实际应用。
2 结果
2.1 问卷收集情况
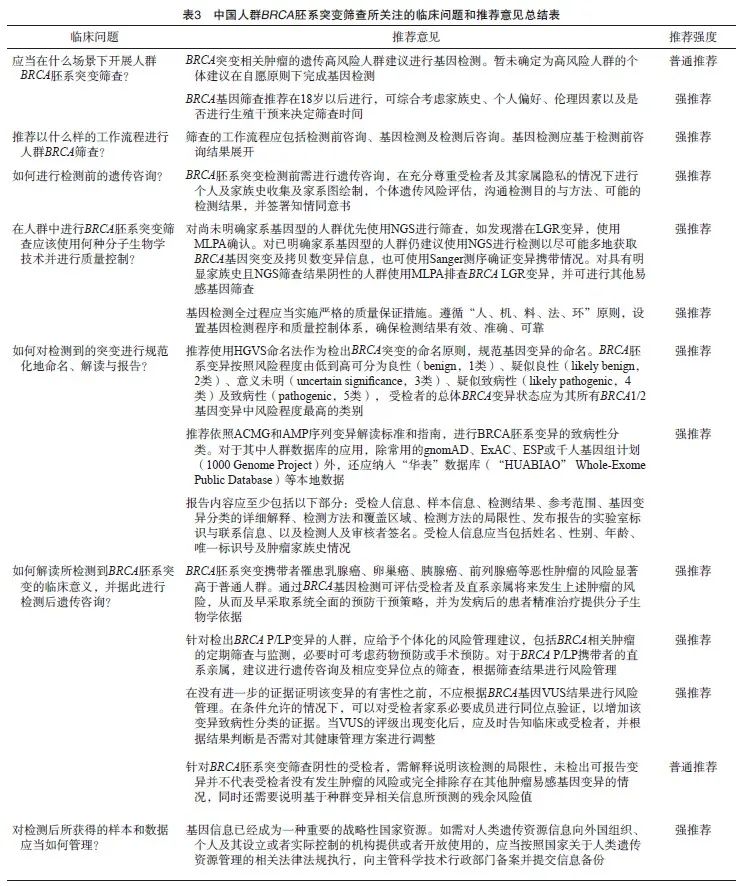
共开展3次问卷调查,45名专家参与问卷及投票,收集了52条专家建议。汇总分析3次问卷数据,基于审核专家的一致意见,共达成14条共识,强推荐的为12条,推荐的为2条,最后经审核并部分修改后定稿。
2.2 共识达成情况
问题1:应当在什么场景下开展人群BRCA胚系突变筛查?
推荐意见1.1:筛查目标人群
BRCA突变相关肿瘤的遗传高风险人群建议进行基因检测。暂未确定为高风险人群的个体建议在自愿原则下完成基因检测(证据等级1级,推荐强度B)。
推荐说明:
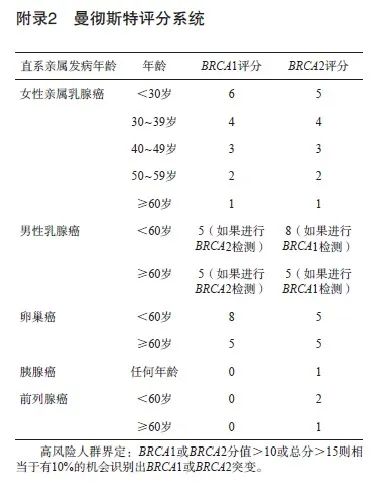
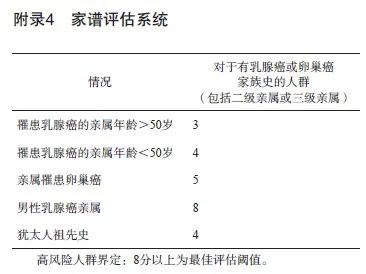
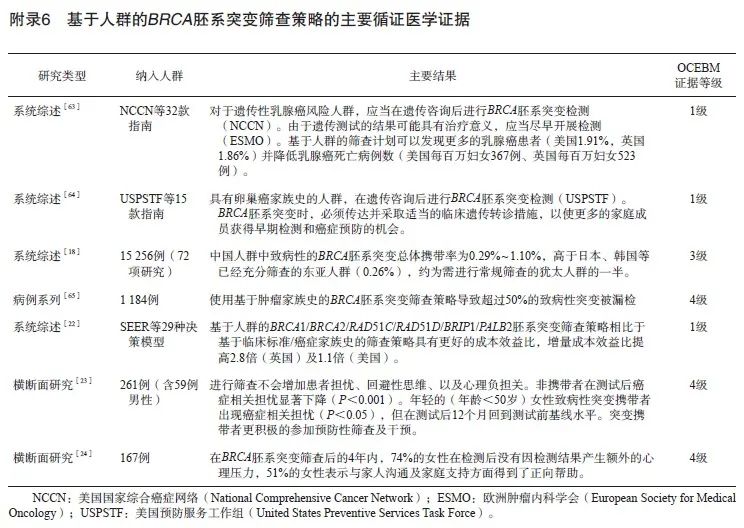
根据一项纳入了63 828例肿瘤患者和37 086名对照者的大型病例对照研究[10]统计,BRCA胚系突变携带者罹患乳腺癌、卵巢癌的风险相比于普通人群分别提高16.1倍(BRCA1) /10.9倍(BRCA2)、75.6倍(BRCA1)/11.3倍(BRCA2)。此外,突变携带者罹患胰腺癌、前列腺癌的风险也对应升高12.6倍(BRCA1) /10.7倍(BRCA2)、1.1倍(BRCA1 )/4.0倍(BRCA2)。另一项横跨30年,囊括490个BRCA胚系有害突变家系的研究[11]显示,BRCA2胚系突变也提高携带者发生黑色素瘤的风险(RR=99.4,95% CI:11.1~359.8)。多项基于中国人群的研究也表明BRCA胚系突变大幅提高上述肿瘤的风险。目前已有美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)乳腺癌、卵巢癌和(或)胰腺癌遗传评估指南2023年V1版[12]、欧洲医学肿瘤学会(European Society for Medical Oncology,ESMO)遗传性乳腺-卵巢癌综合征癌症风险降低和筛查指南2023年版[13]、美国预防服务工作组(United States Preventive Services Task Force, USPSTF)BRCA相关癌症的风险评估、遗传咨询和遗传测试指南2019年版[14]以及国内的《基于下一代测序技术的BRCA1/2基因检测指南(2019版)》[6]均推荐对于具有BRCA胚系突变携带风险的个体进行突变检测。因此,具有上述肿瘤家族史或血缘近亲携带有BRCA胚系突变的人群属于遗传高危人群,建议从肿瘤家族史角度出发,以量表方法进行遗传风险的评估[14-17],国际上常用的遗传风险因素及风险评估阈值详见附录1~5。
BRCA胚系突变在我国总体人群中的发生率为0.29%~1.10%,高于其他东亚国家[18]。由于不同性别突变携带者的肿瘤发生外显率差异有统计学意义[19];且我国目前以小家系为主,突变携带者往往不能接受相应的遗传咨询或对胚系突变阳性的意义与医学风险理解不充分,他们常不会告知家属自身的突变携带情况,这限制了家族史的参考意义。前期在欧美人群中进行的研究[20-21]表明,基于人群的普查相较于单纯基于家族史的BRCA胚系突变筛查策略可以多发现近1倍数量的致病性或疑似致病性突变。对应的筛查决策分析也发现,相比于单纯基于临床标准及肿瘤家族史的筛查策略,对人群进行BRCA胚系突变筛查可以获得更好的社会成本效益比并延长预期寿命[22]。经筛查检测的致病性突变携带者也已证明在后续的体检、治疗中表现出了更高的依从性,且焦虑及抑郁评分较有家族史咨询者下降更明显[23-25]。因此建议无家族史或未明确家族史的人群以自愿为原则,鼓励其进行基因突变的筛查。
BRCA胚系突变筛查可以从已知相关癌症罹患者(包括男性)开始,以尽可能优先检测到家族中具有较大临床意义的突变,随后再进一步对未罹患相关癌症的亲属进行检测[14]。
相关循证医学证据归纳见附录6。
推荐意见1.2:推荐筛查的时机
BRCA基因筛查推荐在18岁以后进行,可综合考虑家族史、个人偏好、伦理因素以及是否进行生殖干预来决定筛查时间(证据等级1级,推荐强度A)。
推荐说明:
针对筛查时机,国外指南推荐接受筛查一般不早于18岁。NCCN指南[12]建议具有遗传风险的人群18~25岁开始接受BRCA胚系突变检测。 ESMO指南[13]则建议BRCA胚系突变检测的确定应基于法定成年(在大多数国家为18岁)或可接受医疗干预的年龄(大约25岁左右)确定,也可以综合家族史、个人意愿以及是否考虑进行胚胎植入前遗传学检测决定筛查时机。目前,国内关于BRCA胚系突变的筛查年龄尚无明确的定论。由于中国法定成年年龄为18岁,考虑到未成年人中罹患BRCA突变相关肿瘤的风险较低,基因检测结果可能给未成年人带来较大的心理压力,因此,建议在18岁以后及早进行BRCA胚系突变筛查并跟进后续针对性预防措施。
问题2:推荐以什么样的工作流程进行人群BRCA筛查?
推荐意见2:筛查的工作流程应包括检测前咨询、基因检测及检测后咨询。基因检测应基于检测前咨询结果展开(证据等级1级,推荐强度A)。
推荐说明:
根据《遗传病二代测序临床检测全流程规范化共识探讨(1):遗传检测前流程》[26],检测前遗传咨询可通过充分全面地采集临床信息,帮助临床医师和受检者明确检测的必要性,协助确认个体化的检测方式,降低医疗成本,提高诊疗功效;同时,检测前咨询有助于受检者充分了解相关基因检测的意义以及检测后可能带来的益处,为检测后咨询奠定基础。在人群BRCA胚系突变筛查前进行检测前遗传咨询的工作应包括详细的健康信息收集、筛查前遗传咨询、检测项目介绍及知情同意书签署(详见2.2.3)。
在中国人群中,前期有包括21 216例乳腺癌[27]、1 131例卵巢癌[28]、1 080例胰腺癌[29]患者及11 386名[9]和6 434名[27]正常人群的多中心BRCA突变筛查数据显示,中国人群中的BRCA胚系突变谱并未显示出创始者突变富集现象,因此应当使用具有更高覆盖通量的基因测序技术进行BRCA胚系突变的检测。由于二代测序(next-generation sequencing,NGS)技术相比于Sanger测序能够以一次检测反映覆盖BRCA基因外显子及其与内含子的交界区,并具有标准化检测系统、可控的质量控制体系,从理论层面有效降低了突变检出假阴性的可能,因此推荐使用NGS作为BRCA胚系突变检测的首选方案。但对于已明确家族史及遗传变异位点的咨询者,也可使用Sanger测序进行确认性检测,但需告知受检者此次检测并未对BRCA基因所有潜在突变进行筛查。此外,对于NGS结果提示存在拷贝数变异,或家族史明确但未检测到(疑似)致病性突变的个体,建议使用多重链接探针扩增(multiplex ligation probe amplification,MLPA)技术确认大片段重排(large genomic rearrangement,LGR)情况[30]。此外,如为了明确家族遗传背景,也可使用已去世患者的组织样品进行家族遗传信息的验证。
在检测完成后,为了确保检测结果的实际医学意义被充分传达至受检者,应再次进行遗传咨询。在此过程中,检测的结果应当被如实、详细地解释,包括结果注释中的多重证据、建议采用的预防方案等。
问题3:如何进行检测前的遗传咨询?
推荐意见3:BRCA胚系突变检测前需进行遗传咨询,在充分尊重受检者及其家属隐私的情况下进行个人及家族史收集及家系图绘制,个体遗传风险评估,沟通检测目的与方法、可能的检测结果,并签署知情同意书(证据等级1级,推荐强度A)。
推荐说明:
根据基因检测伦理学要求,筛查前遗传咨询应遵循自主原则、知情同意原则、无倾向性原则、尊重和保护隐私原则以及公平原则[31]。由于基因检测结果的分析和解读十分依赖于检测前遗传咨询中获取的受检者本人及家族史信息,因此建议检测前遗传咨询的主要内容包括:了解受检者个人及家系BRCA胚系突变相关疾病的病史。
同时由于基因检测的特殊性,且存在检测局限性,因此在检测前遗传咨询过程中,还需与受检者讨论潜在的检测目的;介绍BRCA胚系突变检测项目的检测内容、范围、意义(如预防指导、生育指导、治疗指导及家系健康管理等)、方法、周期及局限性[26,32];同时应告知受检者可能的检测结果及其临床意义,并需告知依据其检测结果家系成员后续可能也需要接受相应的检测和验证。如所在单位BRCA胚系突变筛查涉及到多种检测技术,筛查前遗传咨询中应告知受检者各检测技术的优劣势及局限性,让受检者根据需要作出选择。基于基因检测的自主和知情同意原则,若受检者在充分了解上述内容后仍选择接受检测,则需签署知情同意书,再进行BRCA胚系突变筛查检测。咨询过程中应充分尊重受检者及其家属的隐私,对受检者陈述的信息均应保密,未经其同意不得外泄[31]。咨询室应当确保私密性,咨询期间应不受外界打扰。如果需要其他专业人员一同参与咨询,应事先征得受检者及其家属的同意。
问题4:在人群中进行BRCA胚系突变筛查应该使用何种分子生物学技术并进行质量控制?
推荐意见4.1:BRCA胚系突变检测的常用技术
对尚未明确家系基因型的人群优先使用NGS进行筛查,如发现潜在LGR变异,使用MLPA确认。对已明确家系基因型的人群仍建议使用NGS进行检测以尽可能多地获取BRCA基因突变及拷贝数变异信息,也可使用Sanger测序确证变异携带情况。对具有明显家族史且NGS筛查结果阴性的人群使用MLPA排查BRCA LGR变异,并可进行其他易感基因筛查(证据等级1级,推荐强度A)。
推荐说明:
NGS是目前最常用的BRCA突变检测技术,已有可用的商业化试剂盒。通过设计合适的文库制备方式,NGS技术可在一次反应中实现对BRCA基因上所有外显子区域及保守的内含子区域的准确测序,从而最大限度地获知患者BRCA基因的单个核苷酸突变情况及小片段插入/删失变异[6]。前期有多项研究[30,33]显示,NGS具有较高的灵敏度、特异度和成本效益。BRCA基因突变检测中检出的变异类型包括单个核苷酸变异(single nucleotide variation,SNV)、小片段插入(insertion,Ins)或删除(deletion,Del)及LGR。目前BRCA基因尚未发现胚系突变集中发生的热点区域,致病性的SNV、Ins及Del广泛分布在两个基因的编码序列和保守的内含子序列中。虽然在犹太人群中曾鉴定出发生频率较高的创始者突变,但在中国人群中创始者突变相关的报道仍较少。所以对未明确家系基因型的人群优先使用NGS进行筛查,以保证BRCA的序列变异得到充分的筛查。
但NGS在BRCA突变检测中同样存在一定局限:如NGS对LGR的检测灵敏度和准确度仍然较低,需要MLPA进一步验证,所以发现潜在LGR变异时,需使用MLPA进行验证[30]。Sanger测序在BRCA突变检测中一般用于阳性致病突变的确认复核。该方法操作简单,设备成熟,可提供高准确性的结果,错误率一般低于0.1%。但因为其本身测序成本高,通量低,一般只应用于少量靶点的测序,适用于已知变异位点的测序确认。
研究[22]发现,相比基于家族史的BRCA胚系突变筛查,联合筛查BRCA、RAD51C、 RAD51D、BRIP1、PALB2胚系突变可以在人群中发现近1倍数量的家族性乳腺癌及卵巢癌患者。因此,对具有明显家族史且NGS筛查结果显示BRCA胚系突变为阴性的人群可进行其他易感基因筛查。
推荐意见4.2:建议的检测质量控制和质量保证措施
基因检测全过程应当采取严格的质量保证措施。遵循“人、机、料、法、环”原则,设置基因检测程序和质量控制体系,确保检测结果有效、准确、可靠(证据等级1级,推荐强度A)。
推荐说明:
规范的质量保证措施是保障BRCA胚系突变检测可靠性、准确性、有效性的重要手段。检测质量控制应贯穿于检测的全过程。根据现行检验操作规程[34]、BRCA1/2基因NGS检测指南[6]及2023年10月开始实施的《BRCA基因突变检测试剂盒及数据库通用技术要求:YY/T 1865-2002》[35],使用NGS进行基因检测时应从以下几个方面进行质量控制。
质量控制程序应覆盖样本采集、运输、保存过程。对于NGS检测,推荐使采集2 mL全血,保存于EDTA抗凝管中,常温(15~35 ℃)运输。对于验证性的Sanger测序检测,除使用全血样本外,也可使用唾液或口腔黏膜刮片,使用专用核酸保存管进行采样及运输。如无法即时抽提DNA,应在4 ℃冰箱保存,保存时间不超过1周[34]。
建议根据实验开展的需要和条件合理选择DNA提取方法及试剂,并使用染料法或紫外分光光度法准确计量所得DNA浓度和纯度。目前常用的文库构建方式包括扩增子及杂交捕获两种技术路线。所构建文库的检测目标区域需至少包括编码序列±15 bp。完成建库后,应确认并记录文库DNA浓度及片段大小。文库片段大小可使用毛细管电泳法进行评估[6]。
上机测序完成后需要先对原始数据进行质量控制,再进行后续的生物信息学分析。 Q30或Q20值应当>75%,原始数据GC含量应在45%~60%。基于扩增的最低测序深度应>200×,基于捕获(去冗余后)的最低测序深度应>100×,目标区域的平均测序深度应高于150×。在变异识别中,所检测出BRCA1或BRCA2基因的胚系突变理论突变频率分别为50%或100%。测序深度超过(0.2×平均测序深度)的位点应该占所有目标检测位点90%以上,目标区域的50×覆盖率应>99%。此外,靶区域的测序深度均一性应不低于90%,靶区域检测的覆盖率应达100%。可使用IGV等软件可视化位点情况,进一步确认突变序列。变异解读应包含对变异检测结果进行分类的证据。
除日常实验的质量控制外,为进一步保证检测的准确有效,应在临床应用前对整个实验流程进行验证,评估NGS与其他方法检测结果的一致性。原则上流程中涉及的所有步骤均应使用符合国家药品监督管理局批准上市的试剂耗材及仪器。BRCA基因检测的实验室必须通过相关机构认证,有规范的实验室标准化操作流程,建立严格的质量控制体系,定期参加国际和国内室间质评项目。涉及检测的技术人员必须经过质量管理体系、操作规程、污染防控等技能的培训,并严格按照标准化操作流程操作。生物信息学分析及变异解读人员应具有生物信息学、遗传学或医学专业背景,并接受基因检测相关培训。变异解读人员应具有遗传咨询师资质或经相关遗传咨询培训合格。
问题5:如何对检测到的突变进行规范化命名、解读与报告?
推荐意见5.1:BRCA胚系突变的规范化命名与变异分类
推荐使用人类基因组变异协会(Human Genome Variation Society,HGVS)命名法作为检出BRCA突变的命名原则,规范基因变异的命名。BRCA胚系变异按照风险程度由低到高可分为良性(benign,1类)、疑似良性(likely benign,2类)、意义未明(uncertain significance,3类)、疑似致病性(likely pathogenic,4类)及致病性(pathogenic,5类),受检者的总体BRCA变异状态应为其所有BRCA1/2 基因变异中风险程度最高的类别(证据等级1级,推荐强度A)。
推荐说明:
为保证检测结果的可读性与可比性,应当对所测得的突变及性能规范化命名。同时必需标明参考序列,确保基因变异注释的准确无误。目前国际上通用的变异命名方法为HGVS系统,可使用美国生物技术信息中心参考序列数据库(http://www.ncbi.nlm.nih.gov/refseq/)中的BRCA1/2基因最常用转录本序列作为参考序列,并可使用命名工具(http://mutalyzer.nl/)对基因变异的HGVS命名进行校验。
综合美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)和胚系突变等位基因解读实证联盟(Evidence-based Network for the Interpretation of Germline Mutant Allele, ENIGMA)的分类系统,1~5类BRCA胚系突变的致病可能依次为<0.001、0.001~0.049、0.050~0.949、0.950~0.990、>0.990。拷贝数变异的确认方案建议参考ACMG指南及国立卫生研究院(National Institute of Health,NIH)资助的临床基因组资源中心(ClinGen)联合发布的《原发性拷贝数变异解读与报告技术标准(2019版)》与更新[36]。
推荐意见5.2:变异的致病性分类
推荐依照ACMG和美国分子病理学会(Association for Molecular Pathology,AMP)序列变异解读标准和指南,进行BRCA胚系变异的致病性分类。对于其中人群数据库的应用,除外常用的基因组聚合数据库(Genome Aggregation Database,gnomAD)、外显子组整合数据库(Exome Aggregation Consortium, ExAC )、外显子组测序项目(Exome Sequencing Project,ESP)或千人基因组计划(1000 Genome Project)外,还应纳入“华表” 数据库(“HUABIAO” Whole-Exome Public Database)等本地数据(证据等级1级,推荐强度A)。
推荐说明:
目前,BRCA胚系变异致病性分类最权威的指南或标准包括:ACMG和AMP序列变异解读标准和指南(2015版)[37]、欧洲分子基因诊断质量联盟(European Molecular Genetics Quality Network,EMQN)遗传性乳腺癌/卵巢癌分子遗传分析最佳实践指南(2008年版)[38]和ENIGMA BRCA1/2基因变异分类标准(2.5.1版)[39]。综合以上指南规则,结合本地人群数据库及《BRCA1/2数据解读中国专家共识(2021年版)》[5]给出变异分类方案的推荐。同一变异依据不同指南版本或判断标准所得的致病性分类结果可能略有差异,因此建议在变异分类时具体指明所依据的指南或标准名称。
推荐意见5.3:突变的报告规范
报告内容应至少包括以下部分:受检人信息、样本信息、检测结果、参考范围、基因变异分类的详细解释、检测方法和覆盖区域、检测方法的局限性、发布报告的实验室标识与联系信息、检测人及审核者签名(证据等级1级,推荐强度A)。
推荐说明:
一份完整的BRCA1/2基因检测报告应当包含必要的结果解释和注释信息,便于受检者与临床医师的理解。根据《BRCA1/2数据解读中国专家共识(2021版)》[5]、《临床基因检测报告规范与基因检测行业共识探讨》[40]等专家共识与相关文件,结合专家组意见进行修订,对人群BRCA1/2胚系突变报告提出以下规范要求:受检人信息应当包括姓名、性别、年龄、唯一标识号及肿瘤家族史情况。样本信息部分应包括采样日期、接收日期、报告时间、样本类型及样本状态。检测结果部分应列出所发现的所有4/5类基因变异的名称、位点、频率、总体BRCA突变状态及参考范围。建议列出所发现的3类基因变异,以便进行变异致病性重分析。基因变异分类的详细解释部分应提供基因变异分类证据的简要说明,并指明所依据的变异分类指南或标准名称。检测方法和覆盖区域部分应明确描述使用的BRCA检测方法以及该方法覆盖的指定序列区域。应定期评审并更新分子变异的临床意义,确保其准确性。检测方法的局限性应对所使用检测方法的技术局限进行说明。签名和联系信息部分应列出实验操作、数据分析与报告撰写、报告复核的人员姓名及便于进一步问询的联系信息。数据分析与报告撰写人员应具有临床医学、分子生物学或遗传学背景并通过生物信息学培训考核。最终报告的复核应由授权签字人(高级职称人员或医学博士学位获得者),或中级或硕士以上具有相关背景、经培训考核合格的本单位执业医师审核。
问题6:如何解读所检测到BRCA胚系突变的临床意义,并据此进行检测后遗传咨询?
推荐意见6.1:BRCA胚系突变的临床意义
BRCA胚系突变携带者罹患乳腺癌、卵巢癌、胰腺癌、前列腺癌等恶性肿瘤的风险显著高于普通人群。通过BRCA基因检测可评估受检者及直系亲属将来发生上述肿瘤的风险,从而及早采取系统全面的预防干预策略,并为发病后的患者精准治疗提供分子生物学依据(证据等级1级,推荐强度A)。
推荐说明:
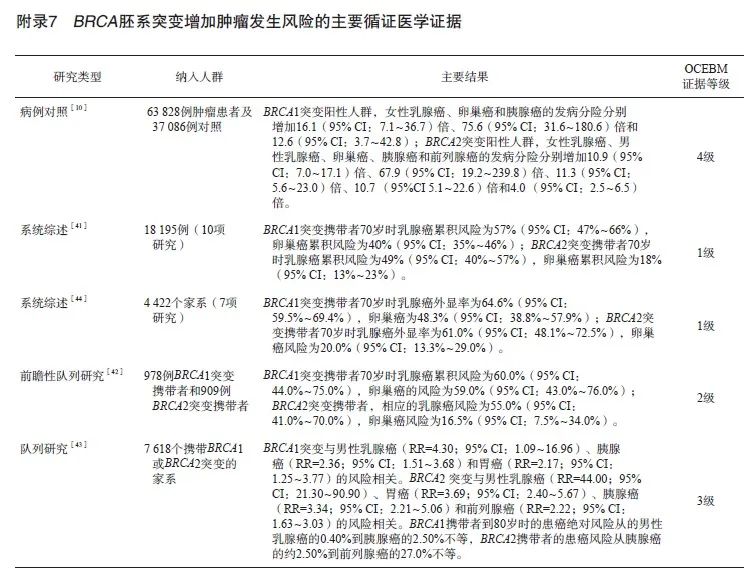
现有证据[41-45]表明,BRCA胚系阳性突变会增加多种肿瘤的发生风险。NCCN 2024年V1版 《遗传性/家族性乳腺、卵巢、胰腺癌高危因素评估指南》指出,BRCA1突变阳性的女性乳腺癌发生风险>60.0%[41-42,46],约是普通人群的16.1(95% CI:7.1~36.7)倍[10],男性70岁前乳腺癌发生风险为0.2%~1.2%[43,47];卵巢癌发生风险达39.0%~58.0%[44],约是普通人群的75.6(95% CI:31.6~180.6)倍[10];胰腺癌发生风险≤5%[43],约是普通人群的12.6(95% CI:3.7~42.8)倍[10];前列腺癌发生风险为7%~26%[48],约是普通人群的1.1(95% CI:0.3~3.4)倍[10]。BRCA2阳性的女性乳腺癌发生风险>60%[41,46],约是普通人群的10.9(95% CI:7.0~17.1)倍[10],男性70岁前乳腺癌发生风险为1.8%~7.1%[43,47,49],约是普通人群的67.9(95% CI:19.2~239.8)倍[10];卵巢癌发生风险达13%~29%[44],约是普通人群的11.3 (95% CI:5.6~23.0)倍[10];胰腺癌发生风险为5%~10%[43],约是普通人群的10.7(95% CI:5.1~22.6)倍[10];前列腺癌发生风险为19%~61%[48,50],约是普通人群的4.0(95% CI:2.5~6.5)倍[10];BRCA2突变阳性也可能提高黑色素瘤的发生风险[11]。因此,BRCA胚系阳性突变人群终生罹患乳腺癌、卵巢癌、胰腺癌、前列腺癌的风险显著高于普通人群,通过检测BRCA胚系突变可筛选罹患上述肿瘤的高风险人群。
BRCA胚系突变阳性也是多腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]抑制剂应用的生物标志物之一。目前已有olaparib[51-52]、rucaparib[53]、niraparib[54]、talazoparib[55]等多种PARP抑制剂获批用于携带BRCA胚系突变的肿瘤患者的治疗。因此,包括NCCN乳腺癌(2023年V4版)、卵巢癌(2023年V1版)、胰腺癌(2022年V2版)、前列腺癌(2023年V1版)临床诊疗指南在内的权威指南均推荐检测BRCA胚系突变以协助临床制订个体化的抗肿瘤治疗方案[56-59]。此外,由于BRCA胚系突变具有可遗传性,针对BRCA检出胚系阳性突变的人群,可通过家系扩大验证来帮助家系高危成员进行相应的预防指导、生育指导、治疗指导及健康管理。
相关循证医学证据归纳见附录7。
推荐意见6.2:BRCA致病性/疑似致病性变异的检测后遗传咨询
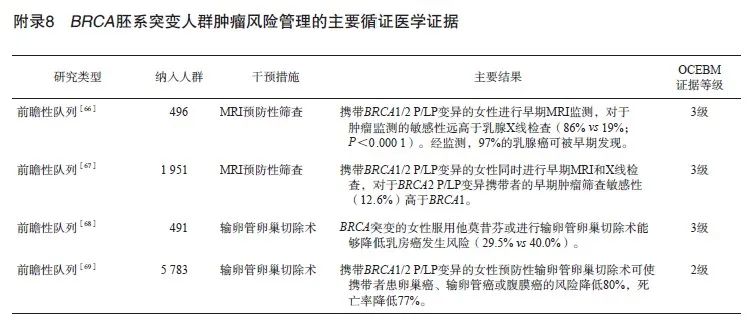
针对检出BRCA基因致病或疑似致病(pathogenic/likely pathogenic,P/LP)变异的人群,应给予个体化的风险管理建议,包括BRCA相关肿瘤的定期筛查与监测,必要时可考虑药物预防或手术预防。对于BRCA P/LP携带者的直系亲属,建议进行遗传咨询及相应变异位点的筛查,根据筛查结果进行风险管理(证据等级1级,推荐强度A)。
推荐说明:
综合ACMG、ENIGMA及ClinGen的变异解读规则,BRCA基因胚系突变筛查检出阳性结果,即检出BRCA P/LP变异,该类人群罹患乳腺癌、卵巢癌、胰腺癌、前列腺癌、黑色素瘤等肿瘤的风险大幅升高。因此针对BRCA胚系突变阳性人群的遗传咨询通常需要考虑整个家系。一般情况下,BRCA基因发生杂合P/LP变异即可使上述肿瘤发生的风险增加。根据孟德尔遗传规律,若受检者检出杂合P/LP变异,通常其父母之一也是杂合携带者,因此父母的兄弟姐妹及受检者本人的兄弟姐妹均有1/2的概率是杂合携带者,其每个子代也有1/2的概率遗传该变异。因此在受检者检出P/LP变异的情况下,建议在亲属知情同意的情况下,对家系中的高危人群进行该P/LP变异的筛查,依据筛查结果,受检者本人及家系高危成员应进行适当的临床随访和检查。
以NCCN乳腺、卵巢和胰腺癌遗传/家族高风险评估指南[3]为主的肿瘤筛查及预防指南建议,针对BRCA胚系突变阳性人群的临床随访和检查,需要考虑的问题有随访和筛查的时间、方式、频率及各种方式的优劣势和必要性,具体建议见表2。
相关循证医学证据归纳见附录8。
推荐意见6.3:BRCA意义未明性变异的检测后遗传咨询
在没有进一步的证据证明该变异的有害性之前,不应根据BRCA基因意义未明变异(variants of uncertain significance,VUS)结果进行风险管理。在条件允许的情况下,可以对受检者家系必要成员进行同位点验证,以增加该变异致病性分类的证据。当VUS的评级出现变化后,应及时告知临床医师或受检者,并根据结果判断是否需对其健康管理方案进行调整(证据等级1级,推荐强度A)。
推荐说明:
BRCA基因胚系突变筛查检出VUS,表明该变异基于目前的研究水平和变异致病性评估可使用的证据,不能评估到P/LP等级,也不能评估到良性/疑似良性等级。这类变异一般没有足够证据支持会明显引起受检者罹患肿瘤的风险增加,但也不能完全排除这些变异增加肿瘤患病风险的可能性,建议可以通过家系验证等进一步明确其临床意义,从而妥善进行健康管理。在没有进一步的证据证明该变异的有害性之前,不应指导临床医师进行相应的风险管理。随着研究的深入或受检者家系表型的增加,VUS可能会出现致病性等级上调或下调的情况[60-61],有这类结果更新信息时应及时告知临床医师和受检者。
针对BRCA基因胚系突变筛查检出VUS的受检者,其健康管理建议根据此类变异致病性的上调或下调情况来选择。若致病性等级上调为P/LP,则根据阳性结果的处理和建议进行;若致病性等级下调或未予调整,则建议根据受检者当前的体检情况进行相应随访和检查。一旦受检者本人或家系成员出现上述肿瘤早发的情况,应及时反馈检验部门,依据家系验证结果进行变异致病性重分析,从而及时调整随访和检查方案。
推荐意见6.4:BRCA良性/疑似良性变异的检测后遗传咨询
针对BRCA胚系突变筛查阴性的受检者,需解释说明该检测的局限性,未检出可报告变异并不代表受检者没有发生肿瘤的风险或完全排除存在其他肿瘤易感基因变异的情况,同时还需要说明基于种群变异相关信息所预测的残余风险值(证据等级3级,推荐强度B)。
推荐说明:
各单位BRCA胚系突变筛查项目的检测范围不尽相同,如在检测范围内未检出BRCA基因P/LP或VUS,则表明本次检测为阴性结果。阴性结果不代表受检者没有上述肿瘤的发生风险,针对该类结果应向受检者进行如下说明:
⑴ 肿瘤是一类因环境影响和多基因共同作用而引发的疾病,BRCA胚系突变筛查未检出可报告变异不代表受检者没有肿瘤的发生风险。
⑵ 本检测仅涵盖BRCA1和BRCA2基因的受检区域,且可分析的变异类型各单位也存在不同的局限性,因此阴性结果仅代表未检出BRCA基因可检测范围内的变异,不代表其他肿瘤易感基因也阴性。
⑶ BRCA1和BRCA2基因变异的相关研究仍在不断开展,随着研究的深入或受检者家系表型的增加,阴性结果可能会出现致病性等级上调的情况,一旦受检者本人或家系成员出现上述肿瘤早发的情况,应及时反馈检验部门,依据家系验证结果进行变异致病性重分析,从而及时调整随访和检查方案[26]。
问题7:对检测后所获得的样本和数据应当如何管理?
推荐意见7:基因信息已经成为一种重要的战略性国家资源。如需对人类遗传资源信息向外国组织、个人及其设立或者实际控制的机构提供或开放使用的,应当按照国家关于人类遗传资源管理的相关法律法规执行,向主管科学技术行政部门备案并提交信息备份[62](推荐强度A)。

3 意见总结
本共识围绕中国人群BRCA胚系突变筛查的目标人群、筛查时机、检测前遗传咨询、检测技术和质量控制、突变的规范化解读与报告、检测后遗传咨询等多个方面开展了德尔菲问卷调查,参与的专家来自全国15个省、自治区、直辖市,所有专家均具有博士学位并任职于大型教学医院或知名大学,在遗传性肿瘤的健康管理筛查、临床诊断以及治疗等领域具有一定的代表性和权威性。在纳入调查的14条意见中,推荐强度为A的强推荐意见为12个,推荐强度为B的普通推荐意见为2个(表3)。
强推荐的推荐意见中,包括中国人群中进行BRCA基因胚系突变筛查的时机、相关检测的工作流程、检测常用技术及质量控制,有1名专家提出MLPA技术临床使用率较低,可将三代测序技术应用于LGR检测。在变异致病性分类及报告的推荐意见条目中,有1名专家指出了国际癌症研究机构(International Agency for Research on Cancer,IARC)指南与ACMG指南在分类方案中的差异,综合考虑国内外对于变异致病性分类指南的接受度,本共识仍推荐使用ACMG指南进行变异致病性分类。
普通推荐的推荐意见中,主要包括对中国人群进行BRCA基因胚系突变筛查受众的建议,该建议得到多数受访专家同意的原因主要是基于相关循证医学证据级别较高,但也有5名专家提出对中国人群进行筛查的获益性支持证据尚不充分的意见。此外,虽然97%的专家均同意对良性/疑似良性变异携带者进行检测后遗传咨询,但因循证医学证据强度未达到OCEMB 3级,因此作为普通推荐意见。
本专家共识局限之处主要在于对中国人群进行胚系突变筛查的循证医学证据尚不充分。本共识主要参考了欧美的风险人群筛查指南及系统综述等[63-69]。在后续的工作中,专家组将开展系列性临床试验,进一步明确在中国人群中进行BRCA胚系突变筛查的参与者获益程度及最佳实践方案。
4 结论和展望
对于具有乳腺癌、卵巢癌等同源重组修复缺陷相关肿瘤风险的个体进行BRCA突变检测可有效地提高疾病早期诊断率及干预有效性,使突变携带者获益。本专家共识通过明确适合进行BRCA胚系突变检测的人群及检查时机,期待促进此类检测的临床应用并达到最合适的卫生经济学效益。同时提出标准化的检测方法学及变异分类方案,以降低报告结果差异对临床医师和患者带来的风险。此外,通过标准化的遗传咨询流程,以最大程度地提高突变携带者获益程度并降低筛查的伦理风险。
伴随着人群BRCA基因突变筛查理念的不断普及和检测成本的进一步下降,一方面中国人群BRCA突变的分子流行病学数据将不断充实,可望鉴定出中国特有的创始突变谱系;另一方面,筛查量的提升也对结果解读、遗传咨询的均一、标准化提出了更高的要求。为了更好地满足中国健康人群筛查的需求,需以实验室建设、流程优化、人才培养为抓手,周期性开展规范化培训。此外,肿瘤组数据及人群随访数据的积累,将为VUS的明确分类提供基于临床真实病例的证据条款;而疑似致病变异的分类也可能因为大规模临床证据的出现而被重新分类。更多的分析工具将被研发。BRCA突变检测将更多地用于风险评估、早期诊断,渗透到从新辅助治疗、手术方案选择、术后放化疗到靶向用药的全程个体化治疗体系。今后的临床研究将逐步探明突变致病的分子机制、同源重组修复通路基因之间的相互调控关系,进而实现同源重组修复缺陷相关肿瘤的全周期式个体化医疗。
利益冲突声明:所有作者均声明不存在利益冲突。
本文作者承诺:作者间、作者与审稿人间、与指南/共识中出现的药物或器械厂商之间无利益冲突;本共识制订过程中无第三方进行赞助。
[参考文献]
[1] JEGGO P A, PEARL L H, CARR A M. DNA repair, genome stability and cancer: a historical perspective[J]. Nat Rev Cancer, 2016, 16(1): 35-42.
[2] NAROD S A, FOULKES W D. BRCA1 and BRCA2: 1994 and beyond[J]. Nat Rev Cancer, 2004, 4(9): 665-676.
[3] DALY M B, PILARSKI R, YURGELUN M B, et al. NCCN guidelines insights: genetic/familial high-risk assessment: breast, ovarian, and pancreatic, version 1.2020[J]. J Natl Compr Canc Netw, 2020, 18(4): 380-391.
[4] 中国医师协会精准治疗委员会乳腺癌专业委员会, 中华医学会肿瘤学分会乳腺肿瘤学组, 中国抗癌协会乳腺癌专业委员会, 等. 中国乳腺癌患者BRCA1/2基因检测与临床应用专家共识(2018年版)[J]. 中国癌症杂志, 2018, 28(10): 787-800.
Breast cancer Professional Committee of Precision Therapy Committee of Chinese Medical Doctor Association, Breast Cancer Group of Cancer Branch of Chinese Medical Association, Breast Cancer Professional Committee of China Anti-Cancer Association, et al. Expert consensus on BRCA1/2 gene detection and clinical application of breast cancer patients in China (2018 edition)[J]. China Oncol, 2018, 28(10): 787-800.
[5] 中华医学会病理学分会, 国家病理质控中心. BRCA1/2数据解读中国专家共识(2021版)[J]. 中华病理学杂志, 2021, 50(6): 565-571.
Chinese Medical Association Pathology Branch, National Pathology Quality Control Center. Chinese expert consensus on BRCA1/2 variant interpretation (2021 version) [J]. Chin J Pathol, 2021, 50(6): 565-571.
[6] 《基于下一代测序技术的BRCA1/2基因检测指南(版)》编写组. 基于下一代测序技术的BRCA1/2基因检测指南(2019版)[J]. 中华病理学杂志, 2019, 48(9): 670-677.
Writing group of guideline on next generation sequencing based BRCA gene testing. Guideline on next generation sequencing based BRCA1/2 testing (2019)[J]. Chin J Pathol, 2019, 48(9): 670-677.
[7] DONG H, CHANDRATRE K, QIN Y, et al. Prevalence of BRCA1/BRCA2 pathogenic variation in Chinese Han population[J]. J Med Genet, 2021, 58(8): 565-569.
[8] GROUP O L O E W. The Oxford levels of evidence 2[EB/OL]. [2023-11-10].https://www.cebm.ox.ac.uk/resources/levels-of-evidence/ocebm-levels-of-evidence.
[9] HASSETT M J, SOMERFIELD M R, BAKER E R, et al. Management of male breast cancer: ASCO guideline[J]. J Clin Oncol, 2020, 38(16): 1849-1863.
[10] MOMOZAWA Y, SASAI, USUI Y, et al. Expansion of cancer risk profile for BRCA1 and BRCA2 pathogenic variants[J]. JAMA Oncol, 2022, 8(6): 871-878.
[11] MORAN A, O’HARA C, KHAN S, et al. Risk of cancer other than breast or ovarian in individuals with BRCA1 and BRCA2 mutations[J]. Fam Cancer, 2012, 11(2): 235-242.
[12] NETWORK N C C. NCCN guidelines version 1.2023. Breast, ovarian, and/or pancreatic cancer genetic assessment[S]. 2023.
[13] SESSA C, BALMAÑA J, BOBER S L, et al. Risk reduction and screening of cancer in hereditary breast-ovarian cancer syndromes: ESMO clinical practice guideline[J]. Ann Oncol, 2023, 34(1): 33-47.
[14] US PREVENTIVE SERVICES TASK FORCE, OWENS D K, DAVIDSON K W, et al. Risk assessment, genetic counseling, and genetic testing for BRCA-related cancer: US preventive services task force recommendation statement[J]. JAMA, 2019, 322(7): 652-665.
[15] 沈松杰, 孙 强, 黄 欣, 等. 中国女性乳腺癌筛查指南(2022年版)[J]. 中国研究型医院, 2022, 9(2): 6-13.
SHEN S J, SUN Q, HUANG X, et al. Breast cancer screening guideline for Chinese women (version 2022)[J]. Chin Res Hosp, 2022, 9(2): 6-13.
[16] 国家卫生健康委员会. 卵巢癌诊疗指南(2022年版)[S]. 2022.
The National Health Commission. Diagnosis and treatment guidelines for ovarian cancer (2022 edition) [S]. 2022.
[17] NELSON H D, HUFFMAN L H, FU R W, et al. Genetic risk assessment and BRCA mutation testing for breast and ovarian cancer susceptibility: systematic evidence review for the US preventive services task force[J]. Ann Intern Med, 2005, 143(5): 362-379.
[18] LEI H J, ZHANG M, ZHANG L Y, et al. Overview on population screening for carriers with germline BRCA mutation in China[J]. Front Oncol, 2022, 12: 1002360.
[19] DALY M B, PAL T, BERRY M P, et al. Genetic/familial highrisk assessment: breast, ovarian, and pancreatic, version 2.2021, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2021, 19(1): 77-102.
[20] GABAI-KAPARA E, LAHAD A, KAUFMAN B, et al. Population-based screening for breast and ovarian cancer risk due to BRCA1 and BRCA2[J]. Proc Natl Acad Sci U S A, 2014, 111(39): 14205-14210.
[21] ZHANG L, BAO Y N, RIAZ M, et al. Population genomic screening of all young adults in a health-care system: a costeffectiveness analysis[J]. Genet Med, 2019, 21(9): 1958-1968.
[22] MANCHANDA R, PATEL S, GORDEEV V S, et al. Costeffectiveness of population-based BRCA1, BRCA2, RAD51C, RAD51D, BRIP1, PALB2 mutation testing in unselected general population women[J]. J Natl Cancer Inst, 2018, 110(7): 714-725.
[23] WATSON M, FOSTER C, EELES R, et al. Psychosocial impact of breast/ovarian (BRCA1/2) cancer-predictive genetic testing in a UK multi-centre clinical cohort[J]. Br J Cancer, 2004, 91(10): 1787-1794.
[24] HALBERT C H, STOPFER J E, MCDONALD J, et al. Longterm reactions to genetic testing for BRCA1 and BRCA2 mutations: does time heal women’s concerns? [J]. J Clin Oncol, 2011, 29(32): 4302-4306.
[25] EVANS O, GABA F, MANCHANDA R. Population-based genetic testing for Women’s cancer prevention[J]. Best Pract Res Clin Obstet Gynaecol, 2020, 65: 139-153.
[26] 王 剑, 顾卫红, 黄 辉, 等. 遗传病二代测序临床检测全流程规范化共识探讨(1): 遗传检测前流程[J]. 中华医学遗传学杂志, 2020, 37(3): 334-338.
WANG J, GU W H, HUANG H, et al. A consensus on the standardization of the next generation sequencing process for the diagnosis of genetic diseases (1)-procedures prior to genetic testing[J]. Chin J Med Genet, 2020, 37(3): 334-338.
[27] LIU Y, WANG H L, WANG X, et al. Prevalence and reclassification of BRCA1 and BRCA2 variants in a large, unselected Chinese Han breast cancer cohort[J]. J Hematol Oncol, 2021, 14(1): 18.
[28] LI A, XIE R, ZHI Q H, et al. BRCA germline mutations in an unselected nationwide cohort of Chinese patients with ovarian cancer and healthy controls[J]. Gynecol Oncol, 2018, 151(1): 145-152.
[29] ZHANG X F, MAO T B, ZHANG B, et al. Characterization of DNA damage response deficiency in pancreatic cancer patients from China[J]. Cancer Commun, 2022, 42(1): 70-74.
[30] WALLACE A J. New challenges for BRCA testing: a view from the diagnostic laboratory[J]. Eur J Hum Genet, 2016, 24(Suppl 1): S10-S18.
[31] 张 学, 季加孚, 徐兵河. 肿瘤遗传咨询(第三版)[M].北京: 人民卫生出版社, 2016.
ZHANG X, JI J F, XU B H, Tumor Genetic Counseling (Third Edition) [M]. Beijing: People’s Health Publishing House, 2016.
[32] TREPANIER A, AHRENS M, MCKINNON W, et al. Genetic cancer risk assessment and counseling: recommendations of the national society of genetic counselors[J]. J Genet Couns, 2004, 13(2): 83-114.
[33] STROM C M, RIVERA S, ELZINGA C, et al. Development and validation of a next-generation sequencing assay for BRCA1 and BRCA2 variants for the clinical laboratory[J]. PLoS One, 2015, 10(8): e0136419.
[34] 尚 红, 王毓三, 申子瑜. 全国临床检验操作规程(第4版)[M]. 北京: 人民卫生出版社, 2016.
SHANG H, WANG Y S, SHEN Z Y. National Clinical Laboratory Operating Procedures (4th Edition) [M]. Beijing: People's Health Publishing House, 2016.
[35] 国家药品监督管理局. BRCA基因突变检测试剂盒及数据库通用技术要求: YY/T 1865-2022[S]. 北京: 中国标准出版社, 2022.
The National Medical Products Administration.General technical requirements for BRCA gene mutation detection kit and database: YY/T 1865-2022 [S]. Beijing: China Standards Publishing House, 2022 .
[36] RIGGS E R, ANDERSEN E F, CHERRY A M, et al. Technical standards for the interpretation and reporting of constitutional copy-number variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics (ACMG) and the Clinical Genome Resource (ClinGen)[J]. Genet Med, 2020, 22(2): 245-257.
[37] RICHARDS S, AZIZ N, BALE S, et al. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424.
[38] LARSSON N, BORG Å, HODGSON S, et al. European Molecular Genetics Quality Network (EMQN) best practice guidelines for molecular genetics analysis in hereditary breast/ovarian cancer [EB-OL]. (2007-10-25)[2016-09-25]. https://www.emqn.org/emqn/digitalAssets/0/232_EMQNBRCAguidelines0908.pdf.
[39] ALLELES E-B N F T I O G M. ENIGMA BRCA1/2 gene variant classification criteria[S]. 2017.
[40] 黄 辉, 沈亦平, 顾卫红, 等. 临床基因检测报告规范与基因检测行业共识探讨[J]. 中华医学遗传学杂志, 2018, 35(1): 1-8.
HUANG H, SHEN Y P, GU W H, et al. Discussion on the standard of clinical genetic testing report and the consensus of gene testing industry[J]. Chin J Med Genet, 2018, 35(1): 1-8.
[41] CHEN S N, PARMIGIANI G. Meta-analysis of BRCA1 and BRCA2 penetrance[J]. J Clin Oncol, 2007, 25(11): 1329-1333.
[42] MAVADDAT N, PEOCK S, FROST D, et al. Cancer risks for BRCA1 and BRCA2 mutation carriers: results from prospective analysis of EMBRACE[J]. J Natl Cancer Inst, 2013, 105(11): 812-822.
[43] LI S, SILVESTRI V, LESLIE G, et al. Cancer risks associated with BRCA1 and BRCA2 pathogenic variants[J]. J Clin Oncol, 2022, 40(14): 1529-1541.
[44] CHEN J B, BAE E, ZHANG L J, et al. Penetrance of breast and ovarian cancer in women who carry a BRCA1/2 mutation and do not use risk-reducing salpingo-oophorectomy: an updated meta-analysis[J]. JNCI Cancer Spectr, 2020, 4(4): pkaa029.
[45] VAIL P J, MORRIS B, VAN KAN A, et al. Comparison of locus-specific databases for BRCA1 and BRCA2 variants reveals disparity in variant classification within and among databases[J]. J Community Genet, 2015, 6(4): 351-359.
[46] [46] BREAST CANCER ASSOCIATION CONSORTIUM, MAVADDAT N, DORLING L, et al. Pathology of tumors associated with pathogenic germline variants in 9 breast cancer susceptibility genes[J]. JAMA Oncol, 2022, 8(3): e216744.
[47] TAI Y C, DOMCHEK S, PARMIGIANI G, et al. Breast cancer risk among male BRCA1 and BRCA2 mutation carriers[J]. J Natl Cancer Inst, 2007, 99(23): 1811-1814.
[48] LECARPENTIER J, SILVESTRI V, KUCHENBAECKER K B, et al. Prediction of breast and prostate cancer risks in male BRCA1 and BRCA2 mutation carriers using polygenic risk scores[J]. J Clin Oncol, 2017, 35(20): 2240-2250.
[49] EVANS D G R, SUSNERWALA I, DAWSON J, et al. Risk of breast cancer in male BRCA2 carriers[J]. J Med Genet, 2010, 47(10): 710-711.
[50] NYBERG T, FROST D, BARROWDALE D, et al. Prostate cancer risks for male BRCA1 and BRCA2 mutation carriers: a prospective cohort study[J]. Eur Urol, 2020, 77(1): 24-35.
[51] KAUFMAN B, SHAPIRA-FROMMER R, SCHMUTZLER R K, et al. Olaparib monotherapy in patients with advanced cancer and a germline BRCA1/2 mutation[J]. J Clin Oncol, 2015, 33(3): 244-250.
[52] DOMCHEK S M, AGHAJANIAN C, SHAPIRA-FROMMER R, et al. Efficacy and safety of olaparib monotherapy in germline BRCA1/2 mutation carriers with advanced ovarian cancer and three or more lines of prior therapy[J]. Gynecol Oncol, 2016, 140(2): 199-203.
[53] SWISHER E M, LIN K K, OZA A M, et al. Rucaparib in relapsed, platinum-sensitive high-grade ovarian carcinoma (ARIEL2 Part 1): an international, multicentre, open-label, phase 2 trial[J]. Lancet Oncol, 2017, 18(1): 75-87.
[54] MIRZA M R, MONK B J, HERRSTEDT J, et al. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer[J]. N Engl J Med, 2016, 375(22): 2154-2164.
[55] AGARWAL N, AZAD A A, CARLES J, et al. Talazoparib plus enzalutamide in men with first-line metastatic castrationresistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial[J]. Lancet, 2023, 402(10398): 291-303.
[56] NETWORK N C C. NCCN clinical practice guidelines in oncology-breast cancer (version 4. 2023)[S]. 2023.
[57] NETWORK N C C. NCCN clinical practice guidelines in oncology-ovarian cancer including fallopian tube cancer and primary peritoneal cancer (version 1. 2023)[S]. 2023.
[58] NETWORK N C C. NCCN clinical practice guidelines in oncology-pancreatic adenocarcinoma (version 2. 2022)[S]. 2023.
[59] NETWORK N C C. NCCN clinical practice guidelines in oncology-prostate cancer (version 1. 2023)[S]. 2023.
[60] MERSCH J, BROWN N, PIRZADEH-MILLER S, et al. Prevalence of variant reclassification following hereditary cancer genetic testing[J]. JAMA, 2018, 320(12): 1266-1274.
[61] ESTERLING L, WIJAYATUNGE R, BROWN K, et al. Impact of a cancer gene variant reclassification program over a 20-year period[J]. JCO Precis Oncol, 2020, 4: PO.20.00020.
[62] 中华人民共和国国务院. 中华人民共和国人类遗传资源管理条例:国务院发[2019]717号(2019-6-10)[EB/OL]. [2023-10-1]. https://www.gov.cn/zhengce/content/2019-06/10/content_5398829.htm.
The State Council of the People's Republic of China. Regulations of the People's Republic of China on the Management of Human Genetic Resources: State Council Document [2019] No. 717(2019-6-10) [EB/OL]. [2023-10-1]. https://www.gov.cn/zhengce/content/2019-06/10/content_5398829.htm.
[63] FORBES C, FAYTER D, KOCK S D, et al. A systematic review of international guidelines and recommendations for the genetic screening, diagnosis, genetic counseling, and treatment of BRCA-mutated breast cancer[J]. Cancer Manag Res, 2019, 11: 2321-2337.
[64] ECCLES D M, BALMAÑA J, CLUNE J, et al. Selecting patients with ovarian cancer for germline BRCA mutation testing: findings from guidelines and a systematic literature review[J]. Adv Ther, 2016, 33(2): 129-150.
[65] KEMP Z, TURNBULL A, YOST S, et al. Evaluation of cancerbased criteria for use in mainstream BRCA1 and BRCA2 genetic testing in patients with breast cancer[J]. JAMA Netw Open, 2019, 2(5): e194428.
[66] PASSAPERUMA K, WARNER E, CAUSER P A, et al. Longterm results of screening with magnetic resonance imaging in women with BRCA mutations[J]. Br J Cancer, 2012, 107(1): 24-30.
[67] PHI X A, SAADATMAND S, DE BOCK G H, et al. Contribution of mammography to MRI screening in BRCA mutation carriers by BRCA status and age: individual patient data meta-analysis[J]. Br J Cancer, 2016, 114(6): 631-637.
[68] METCALFE K, LYNCH H T, GHADIRIAN P, et al. Contralateral breast cancer in BRCA1 and BRCA2 mutation carriers[J]. J Clin Oncol, 2004, 22(12): 2328-2335.
[69] FINCH A P, LUBINSKI J, MØLLER P, et al. Impact of oophorectomy on cancer incidence and mortality in women with a BRCA1 and BRCA2 mutation[J]. J Clin Oncol, 2014, 32(15): 1547-1553.



作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#专家共识# #BRCA1# #BRCA2# #二代测序# #同源重组# #突变筛查#
72