《Journal of Clinical Oncology》杂志的肿瘤科大查房(Oncology Grand Rounds)系列旨在将发表于杂志上的原始报告纳入临床背景进行呈现,案例介绍之后为诊断和管理的挑战,相关文献的回顾,以及作者建议的管理方法。该系列的目的是帮助读者更好地理解如何将关键研究的结果应用到自身临床实践。
对于MDS,只有异基因造血干细胞移植(HCT)有治愈可能,但哪些患者最适合HCT及HCT的最佳时机仍未明确。今年5月《Journal of Clinical Oncology》发表了一项重要研究,Tentori等开发和验证了一个决策支持系统,以IPSS-M提供的临床和基因组信息为MDS患者定义异基因造血干细胞移植的最佳时机。研究证实低危和中低危患者可受益于延迟移植,而中高危、高危和极高危患者应立即移植。该研究为将基因组特征纳入移植决策过程的临床价值提供了证据,实现MDS患者异基因移植的风险和疗效个性化权衡。
基于上述研究,近日《Journal of Clinical Oncology》肿瘤科大查房系列发表文章“Revisiting Timing and Decision Modeling for Allogeneic Hematopoietic Stem-Cell Transplantation in Myelodysplastic Syndromes”,通过一个案例探讨了MDS患者异基因移植的时机和决策模型。

病例
患者为68岁男性,既往体健,表现为轻度疲劳,发现血细胞减少。CBC显示血红蛋白9.5 g/dL,绝对中性粒细胞计数1900 /mL,血小板计数107000 /mL。患者接受骨髓检查,骨髓母细胞计数为8%,细胞遗传学正常。分子学分析显示,DNMT3A突变(变异等位基因频率[VAF] 21.5%)和TP53单突变(VAF 12.2%)无TP53杂合性缺失或KMT2A基因部分串联重复。诊断为骨髓增生异常综合征,考虑异基因移植。
MDS的预后评分系统
目前最初广泛使用的MDS预后评分系统是国际预后评分系统(IPSS),该系统使用骨髓原始细胞计数、血细胞减少和细胞遗传学将患者分为四个风险组。后续出现了修订的IPSS评分系统(IPSS-R),其来源于更大的患者数据集,将风险分为五组,并添加了额外的预后标志物(年龄、体能状态、铁蛋白和LDH)来估计总生存期。最新的、含分子信息的、IPSS 评分系统 (IPSS-M) 结合了分子学特征(点突变、TP53杂合性缺失和涉及 KMT2A 和 FLT3 的基因复制)来进一步完善预后。对于白血病转化概率、无白血病生存期和总生存期,IPSS-M比 IPSS-R 的区分能力更强。许多研究小组也在临床实践中验证了 IPSS-M 的鉴别能力,并证明该系统优于IPSS-R。尽管已经开发了 MDS 的其他预后评分系统和更新的病理分类系统,但 IPSS-M 现在是所有其他评分系统的参照物。
IPSS预后评分系统和该患者预后的总结见表1。
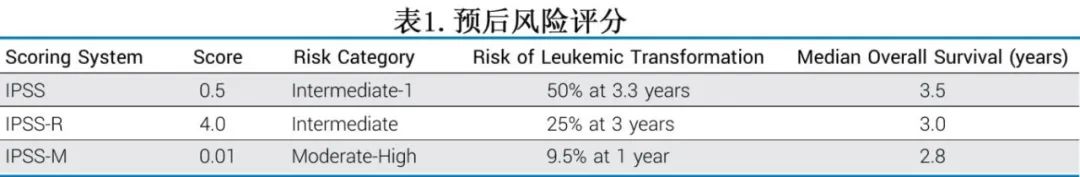
前瞻性证据确定了异基因造血细胞移植的作用
在美国,MDS是异基因HCT继急性髓性白血病之后的第二常见指征。晚期患者的3年预后几乎与早期患者一样良好,总生存率接近50%。虽然MDS是一种老年人的疾病,不太可能有合适的相合同胞供者,但有充分的当代证据表明,非亲缘供者、不全相合非亲缘供者、单倍型供者和脐带血也是合适的干细胞和供者选择。此外,来自大型前瞻性数据系列的数据明确表明,,年龄本身不应成为HCT的禁忌。与单纯年龄相比,年龄调整的合并症指数在确定发病率和死亡率风险方面更优,标准化的老年评估可用于确定未明确的候选人是否适合移植。
多项研究前瞻性地比较了非HCT治疗与HCT治疗的结局且结果非常相似。在所有这些案例中,由于并非所有HCT候选患者都有现成的供者,因此采用了基于合适HCT供者的生物学分配策略,而分配HCT或不进行HCT通常认为不可行。第一项生物学分配研究共将162例法国患者分配到HCT组(n=112)或不进行HCT组(n=50),尽管包括了风险较低和继发性MDS的患者,但结果显示,HCT组3年总生存率提高了一倍(图1A)。同样,德国VidazaAllo研究分析了83例接受HCT的患者,并与一个小的非HCT队列(n=26)进行了比较,证明前者的长期预后改善(图1B)。最近,血液和骨髓移植临床试验网络(BMT CTN) 1102研究纳入384例年龄在50-75岁的IPSS中危-2/高危患者,其中260例在入组后90天内确定了HLA相合亲缘或非亲缘供者,并预计在6个月内接受HCT。在意向治疗分析中,总生存期几乎翻了一番(47.9% vs 26.6%, P=0.0001,图1C)。此外重要的是,结局的改善并没有以牺牲生活质量为代价,且HCT前的生活质量最能预测HCT后的生活质量。在这种情况下,异基因HCT是一种成本效益很高的治疗手段。
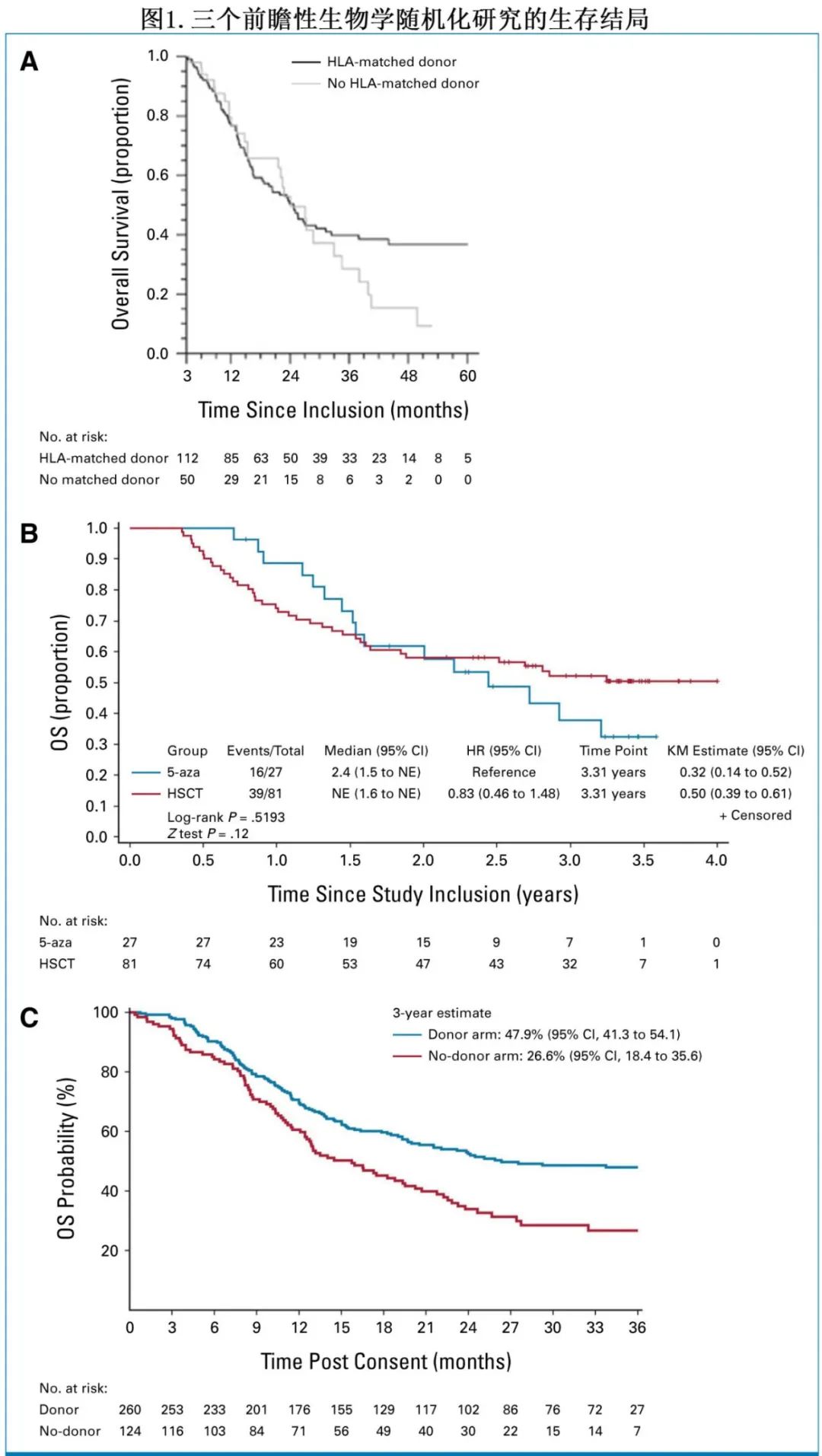
使用IPSS评分系统的决策工具
虽然HCT是MDS的唯一治愈手段,但它可能存在巨大的风险,因此并非所有患者都能从立即HCT治疗中获益。因此,基于计算机的临床试验模拟,以评估MDS中异基因HCT的最佳时机,已用于临床决策超过20年。这些计算机研究可对患者和时间因素进行微观模拟,以建议在无法进行前瞻性临床试验时进行HCT的最佳时机。对于年轻MDS患者的清髓性移植,通过IPSS分层,中危2或高危患者立即进行HCT可获得生存优势,而另一项分析表明,中危1患者立即进行HCT也可提高生存率。随后一项研究评估了HCT与去甲基化治疗在60 - 70岁人群中的作用,发现将移植限制在中危2或高危IPSS与更好的结局相关。一项研究使用IPSS-R评分系统,并考虑不同的患者年龄范围,发现在IPSS-R中期移植的决策策略与所有年龄范围的最大结局相关。在这项分析中,通过IPSS-R而非IPSS进行风险分层会导致29%的患者修改其策略,从而导致额外的2年预期寿命。
Tentori等是第一个使用IPPS-M作为移植决策的工具。作者最初在1125力患者的训练队列中验证了IPSS-M作为HCT结局的判别标准,并使用该队列开发了HCT时机决策工具,该工具在另外613例患者队列中得到验证。该决策工具使用了迄今为止最复杂的建模技术。作者最初建立原因特异性灵活生存模型,以确定可能的 MDS 相关健康状态之间的转换概率。利用这些模型,构建微模拟半马尔可夫模型来确定最佳移植时机,进一步将其分为即刻和延迟移植,用于临床决策目的。无论年龄大小,建议 IPSS-M 中-高危、高危或极高危患者立即接受移植(HCT的最佳时机在诊断后1-10个月之间变化),训练集和验证集之间的数据一致。年龄≥61岁的中-低危患者也建议立即进行移植,但对于其他风险组,建议采用延迟 HCT,尽管培训和验证队列之间存在一些差异。但这些建议需要谨慎解释。需要特别注意的是,当最佳移植时间的95%置信区间下限(而非最佳移植时间估计值本身)距离 MDS 诊断 < 12个月时,建议立即进行移植。在实践中,这可能导致关于立即移植建议的频繁问题。例如,对于61岁以上的中-低危IPSS-M MDS 患者,立即移植的建议是基于点估计值,最佳移植时间为诊断后24和16个月(在训练和验证数据集中),因为这些估计值周围的相应置信区间均在1-35个月之间(原文的表1)。因此,提醒读者不仅要查看手稿和决策工具中图3所示预期生存曲线的形状和方向性,还要查看曲线实线所示的置信区间宽度。
TP53对结局的影响
肿瘤抑制基因TP53突变会给MDS患者带来不良的临床结局,包括接受HCT的患者。最近对378例TP53突变MDS患者的分析发现,非移植患者的不良结局是由TP53等位基因失活(多打击)的患者驱动的,与TP53未突变的患者相比,TP53单等位基因突变MDS具有相似的长期结局。与此相一致的是,研究表明,TP53突变只有在与复杂的细胞遗传学异常相关时才会表现不良预后。
来自BMT CTN 1102研究的309例患者接受了113个基因的统一靶向测序,作为二次数据分析的一部分。87例TP53突变患者中有48例存在多重基因改变(≥2个突变或1个突变伴杂合性缺失或17p染色体缺失),其余39例为单点突变。尽管在所有移植患者中,由于复发风险超过60%,TP53突变与预后较差相关,但与无HCT策略相比,存在TP53突变的HCT仍与显著提高生存率相关(风险比3.89,P<0.001)。在接受HCT的TP53突变组中,3年生存率接近25%,且单纯TP53突变比多发TP53突变更优。尽管这些患者的绝对生存获益不大,但HCT治疗相对于非HCT治疗的获益并不局限于特定的患者亚组,包括 HCT 前去甲基化药物治疗后根据VAF、核型复杂性或突变清除定义的亚组。值得注意的是,基线TP53突变中有94%在 HCT 前样本中持续存在,使用5%或2%的 VAF 阈值,HCT前 TP53 清除或未清除的患者之间3年 OS 无差异。
该病例的治疗决策
该患者的 IPSS-M 评分为中-高危,预期中位总生存期仅为2.8年,在诊断的第一年内发生 AML 的风险接近10%,建议立即进行移植,最佳移植时机的置信上限为5个月(使用训练集数据)。置信区间较窄的即刻移植建议是关键信息。值得注意的是,使用相同的训练数据集,但替代 IPSS-R 预后评分(中危),仍提出类似的建议,正如使用 IPSS-R 评分系统的第一次决策分析中所做的。除决策工具建议外,在这种情况下驱动临床决策的是无临床共病和在低 VAF 下存在 TP53 突变。所有单等位基因或双等位基因 TP53 突变患者(不考虑年龄)的最佳策略是立即移植。这里的估计值置信区间较窄,与移植延迟相关的结果急剧下降。此外,已知在无 HCT 的情况下,TP53突变 MDS 的结局均较差,即使估计的长期无病生存期约为25%也具有吸引力。使用经验证的 HCT 共病指数(校正年龄),预计 HCT 后2年的非复发死亡率低于20%,进一步验证了 HCT 作为首选策略。
参考文献
1.Corey Cutler.Revisiting Timing and Decision Modeling for Allogeneic Hematopoietic Stem-Cell Transplantation in Myelodysplastic Syndromes.J Clin Oncol . 2024 Jun 28:JCO2400649. doi: 10.1200/JCO.24.00649.
2.Tentori CA,et al.Clinical and Genomic-Based Decision Support System to Define the Optimal Timing of Allogeneic Hematopoietic Stem-Cell Transplantation in Patients With Myelodysplastic Syndromes.J Clin Oncol . 2024 May 9:JCO2302175. doi: 10.1200/JCO.23.02175.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#期刊论坛#有用的知识又增加啦
63
#MDS# #异基因移植#
60