近日,中山大学附属第一医院肝胆胰外科中心学科带头人匡铭教授团队在肝癌消融后复发的机制研究取得重要进展。该研究成果在消化系统疾病国际著名学术期刊Hepatology上发表,文章题目为“Eliminating METTL1-mediated accumulation of PMN-MDSCs prevents HCC recurrence after radiofrequencyablation”。该研究成果为研发预防和治疗肝癌消融后复发的药物提供新的思路。

射频消融(Radiofrequency ablation, RFA)是广泛应用于早期肝癌的根治性治疗方法,通过引起肿瘤区域局部高热,直接导致肿瘤细胞发生凝固性变性和坏死,达到良好的治疗效果。但是,和其他根治性治疗方式一样,RFA治疗后的高复发率是治愈肝癌的一大挑战。通常,对于体积较大、边界不规则的肿瘤或存在影像不能检测到的微转移灶时,RFA 治疗难以覆盖所有肿瘤细胞达到根治,容易发生不全消融(insufficientRFA, iRFA),导致肝癌复发。有效控制 iRFA 对肿瘤产生的不良影响,是提高RFA 治疗效果,减少复发的关键。
研究发现,与消融前肿瘤组织相比,消融后复发的肿瘤组织中甲基化转移酶1(METTL1)的表达显著升高。同时,肿瘤组织中发挥免疫抑制作用的PMN-MDSC浸润增多而抗肿瘤免疫的CD8+T细胞浸润减少。
METTL1是tRNA的m7G修饰酶,通过影响基因的翻译,调控肿瘤的发生发展过程。在体外细胞模型中,模拟不全消融后进行RNC-seq发现,热应激后TGF-β通路显著激活。分析该通路中基因的翻译倍数变化以及m7G tRNA密码子频率后发现,TGF-β2是METTL1的重要下游靶点,并且能够诱导PMN-MDSC的扩增。
随后,在小鼠不全消融模型中,研究人员观察到不全消融后,肿瘤进展加速。通过肿瘤组织单细胞测序、流式细胞术分析发现,与对照组相比,不全消融后METTL1表达显著升高,PMN-MDSC浸润增多而CD8+T细胞显著减少。利用METTL1肝特异性敲除小鼠和METTL1过表达小鼠模型进一步验证了METTL1在塑造肿瘤免疫抑制微环境的作用。
在小鼠肿瘤细胞中敲除Mettl1或者Tgfβ2,使用Ly6G中和抗体或TGF-β通路抑制剂均能显著抑制不全消融后残余肝癌进展,并改善肿瘤免疫抑制微环境。该研究结果为以METTL1-TGF-β2-PMN-MDSC轴为靶点开发药物减少肝癌消融后复发提供了重要的新思路。
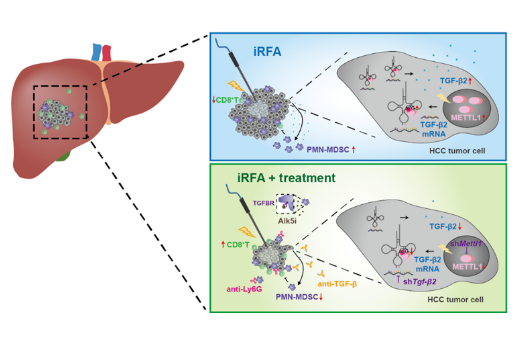
▲不全消融促进METTL1介导的TGF-β2翻译,使得肿瘤中PMN-MDSC增多而CD8+T细胞减少,阻断METTL1- TGF-β2-PMN-MDSC轴,有效抑制不全消融后残留肝癌进展。
中山一院匡铭教授团队的特聘副研究员曾雪贞是该论文的第一作者,匡铭教授团队在读博士生廖冠睿和消化内科在读硕士生黎淑敏是共同第一作者,匡铭教授是最后通讯作者,精准医学研究院王骥研究员是共同通讯作者。
论文链接:
Xuezhen Zeng, et al. Eliminating METTL1-mediated accumulation of PMN-MDSCs prevents HCC recurrence after radiofrequency ablation.https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32585
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#复发机制#
88
#消融#
0
#EPA#
109