《柳叶刀》:治疗肺癌,极具前景的4大类方案,一文掌握
2024-10-10 医学新视点 医学新视点
近期,《柳叶刀》(The Lancet)发表关于晚期NSCLC治疗前景的综述,详细阐述了靶向治疗、免疫治疗、抗体偶联药物、新型疗法等在NSCLC中的治疗进展,以期为临床提供参考。
肺癌是全球癌症相关死亡的主要原因,约85%肺癌是非小细胞肺癌(NSCLC)。靶向治疗和免疫治疗从根本上改变了NSCLC的治疗模式,抗体偶联药物(ADC)和双特异性抗体正在被纳入相关治疗指南。此外,新兴疗法,如T细胞结合剂、细胞疗法、癌症疫苗等也取得了一定进展。
近期,《柳叶刀》(The Lancet)发表关于晚期NSCLC治疗前景的综述,详细阐述了靶向治疗、免疫治疗、抗体偶联药物、新型疗法等在NSCLC中的治疗进展,以期为临床提供参考。
 截图来源:The Lancet
截图来源:The Lancet
具有致癌驱动分子改变的肺癌靶向治疗
大约50%的非鳞状NSCLC患者存在基因突变,称为具有致癌驱动分子改变的基因突变。不同国家和地区人群突变基因存在差异,亚裔EGFR突变率较高,KRASG12C突变率较低。
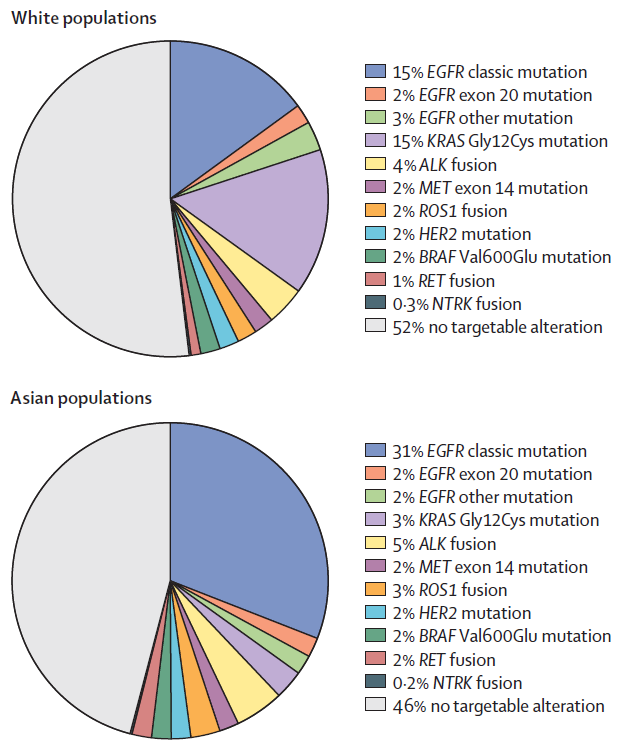
▲亚裔(下方饼图)和白人(上方饼图)非鳞状NSCLC不同基因突变类型和比例(图片来源:参考文献[1])
在疾病晚期识别是否有基因突变是至关重要的,因为需要针对基因突变采取特异性治疗干预策略。EGFR、KRAS、HER2、BRAF、MET、ALK、ROS1、RET、NTRK1/2/3等基因突变驱动的NSCLC可采用多种靶向治疗策略。当前,KRAS和HER2突变,建议从二线治疗开始启动靶向治疗,其他具有致癌驱动分子改变的晚期NSCLC均在一线治疗即采用靶向治疗。靶向治疗也有迭代发展,主要为酪氨酸激酶抑制剂(TKI)口服给药,有望使患者缩短住院时长,延迟化疗。虽然相关药物存在特异性和实质性的药物不良反应作用,如皮肤毒性和神经毒性,但耐受性通常较好。
EGFR是肺癌患者最常见的突变,其中85%~90%为第19号外显子的非移码缺失突变(Ex19del)和21号外显子(L858R)错义突变,属于典型突变。余下10%~15%为非典型突变,包括G719X、L861Q、S7681及EGFR外显子20号插入突变(EGFR ex20in)。
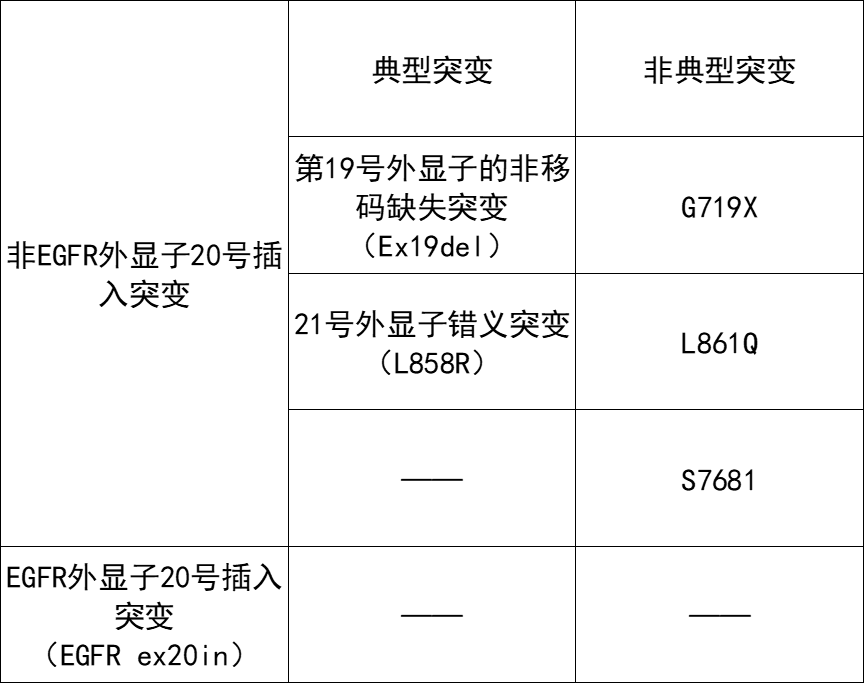
▲NSCLC突变类型(图片来源:药明康德内容团队自制)
非EGFR ex20in一线治疗策略是靶向治疗,且而典型突变对EGFR-TKIs敏感性高于非典型突变,而EGFR ex20in标准治疗为化疗。
典型EGFR突变
奥希替尼是典型EGFR突变标准一线治疗策略。既往研究发现,相比于奥希替尼单药治疗,奥希替尼+化疗以及奥希替尼+amivantamab(一种靶向EGFR和c-MET的双特异性抗体)+lazertinib(一种第三代EGFR TKI)两种联合用药策略可改善无进展生存期,但整体生存数据仍有待后续确认,且联合用药可能产生额外的药物不良反应,因此对于患者的一线治疗策略需要同时考虑到杀灭肿瘤、合并症和患者偏好等问题。目前,奥希替尼联合贝伐珠单抗的研究正在进行中。
非典型EGFR突变
阿法替尼是第二代EGFR TKI,在初始接受治疗的非典型EGFR突变NSCLC患者中,相比于化疗,在延长无进展生存期方面更具优势,被批准作为一线治疗策略。奥希替尼是治疗非典型EGFR突变的NSCLC选择之一,但相关数据较少。
EGFR ex20in突变
EGFR ex20in突变是EGFR的第三大突变,其恶性程度高,亚型多达100多种,患者预后差。含铂类的基础化疗是这类突变NSCLC患者的一线治疗策略。一项3期临床试验结果发现,相比于单独化疗,amivantamab+化疗可改善患者无进展生存期,有望成为新的一线治疗策略。舒沃替尼是靶向EGFR ex20in的EGFR TKI,已在中国获批,相关研究显示,其可使初始接受治疗的患者达到73%的客观缓解率(ORR)。另一种抗EGFR单克隆抗体becotarug(JMT-101)与奥希替尼联用,也可达到50%的ORR。此外,其他药物,如zipalertinib和poziotinib正在开展相关临床试验。
尽管初始治疗缓解率均较高,但仍需考虑到肿瘤对EGFR TKI产生的耐药性问题。既往针对EGFR TKI耐药治疗多采用以铂类为基础的化疗,但随着一线治疗策略的丰富和科学界对耐药机制理解的加深,未来耐药治疗方案也可能发生变化。对于使用奥希替尼后疾病进展的患者,相比于单独化疗,amivantamab+化疗无进展生存期更长,总生存期数据尚不成熟。另外一种抗PD-1-VEGF双特异性抗体ivonescimab联合化疗,也显示出优于单独化疗更长的无进展生存期,总生存期数据尚不成熟。此外,抗体偶联药物(ADC),如patritumab deruxtecan也在开展相关研究。
免疫疗法
靶向CTLA 4或PD-L1通路的免疫检查点抑制剂(ICI)可显著改善患者生存率,是无可靶向突变或KRAS突变晚期NSCLC患者的一线治疗策略。治疗决策与癌细胞上PD-L1的表达有关,通常可分为高表达(PD-L1表达率≥50%)、中等表达(PD-L1表达率1%~49%)、低表达或阴性(PD-L1表达率<1%)。
PD-L1表达率≥50%
PD-L1高表达的患者均可从抗PD-1疗法或抗PD-L1疗法单药、或是与化疗联用中获益,但目前尚且不明确抗PD-1疗法或抗PD-L1疗法单药与化疗联用能否改善患者临床结局。目前有相关研究对此进行了探索,一项纳入12项随机对照试验的研究,分析了单独免疫治疗与免疫治疗+化疗在PD-L1高表达NSCLC患者中的疗效,结果显示,联合治疗组患者中位总生存期为25个月,而免疫治疗组为12个月。正在进行的一项帕博利珠单抗 vs. 帕博利珠单抗+铂类化疗的3期试验或有望解答上述问题。
此外,我们还需考虑到临床治疗存在较大差异,以及多种因素的影响,如患者吸烟状况、免疫治疗耐药性突变的存在、肿瘤负荷等。当前,科学家们也在探索创新的免疫调节治疗方式,如靶向T细胞免疫球蛋白和ITIM结构域蛋白(TIGIT),其在多种类型的T细胞表面表达,抑制T细胞的激活,是近年来备受关注的新兴肿瘤学靶点。
PD-L1表达率1%~49%
PD-L1中等表达的NSCLC的标准治疗策略是抗PD-1疗法或抗PD-L1疗法+化疗,因为既往研究证实联合治疗患者的总生存期和无进展生存期均优于单独化疗。此外,也有研究探索双重ICIs(抗PD-1疗法或抗PD-L1疗法与抗CTLA 4)+化疗的效果,一项研究就纳武利尤单抗、低剂量伊匹木单抗+2个化疗周期 vs. 4个化疗周期,结果发现ICIs联合治疗可提高总生存率。另一项研究则探索了度伐利尤单抗+tremelimumab+化疗 vs. 度伐利尤单抗+化疗 vs. 单独化疗的效果,结果显示相比于单独化疗,两种免疫治疗组合方式的无进展生存期均更优,但仅在双重ICI+化疗组中观察到总生存期优势。此外,另有研究发现,相比于单独化疗,纳武利尤单抗+伊匹木单抗可显著改善总生存期,这为无法耐受化疗或不愿意化疗的患者提供了替代选择治疗方案。
迄今为止,尚未有直接对比双重ICI(靶向PD-1或PD-L1和CTLA 4)联合或不联合化疗 vs. 抗PD-1疗法或抗PD-L1疗法联合化疗的研究,相关指南建议临床决策时应综合考虑疗效、潜在毒性和患者偏好等事项。
PD-L1表达率<1%
对于PD-L1低表达或阴性的患者,抗PD-1疗法或抗PD-L1疗法联合化疗的方案可改善患者生存期,但这种改善在第5年时停止,这意味着单独的PD-L1状态或不是充分预测ICI疗效的生物标志物。不过抗PD-1疗法或抗PD-L1疗法联合抗CTL 4对这部分患者有益,可能是有价值的治疗策略。
抗体偶联药物
抗体偶联药物在NSCLC的治疗中仍处于早期探索阶段,但正在进行的相关试验结果公布后将有望改变现有指南。目前,抗体偶联药物多用于NSCLC的后线治疗,迄今为止也仅被推荐用于一线治疗后进展的晚期HER2突变NSCLC患者。由于抗体偶联药物疗效不仅取决于肿瘤细胞上靶向抗原的表达情况,其同时也具有其他杀伤机制,如旁观者效应,这就对如何精准发现哪些患者能从抗体偶联药物中受益这一问题提出了挑战。
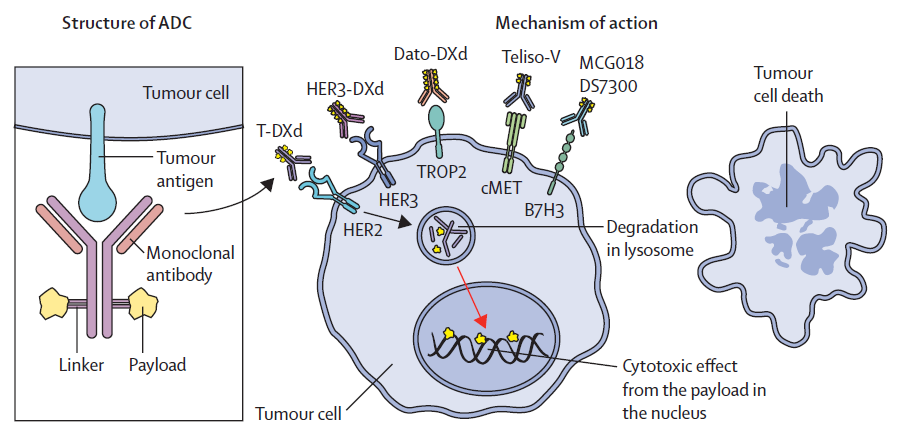
▲抗体偶联药物治疗NSCLC的作用机制(图片来源:参考文献[1])
对于HER2突变NSCLC患者,已有两种抗体偶联药物被纳入二线治疗指南,分别为恩美曲妥珠单抗和德曲妥珠单抗,二者可使约半数患者肿瘤缓解(38%和55%),德曲妥珠单抗在中枢神经转移患者中也显示出具有希望的活性,目前一项3期临床试验正在探索将德曲妥珠单抗用于中枢神经转移患者一线治疗的可行性。与其他具有HER2改变的实体瘤不同,NSCLC疗效更佳生物标记物是HER2基因突变,而不是HER2蛋白表面表达。
Telisotuzumab vedotin(Teliso-V)是靶向MET表面蛋白的药物,一项针对c-MET阳性NSCLC患者的2期研究结果显示,Teliso-V治疗后患者客观缓解率为36%,在MET蛋白高表达和EGFR野生型NSCLC的患者中,客观缓解率可增加至52%,但在EGFR突变患者中则下降到12%。基于该研究结果,美国FDA授予Teliso-V为突破性疗法认定,用于治疗铂类治疗后进展的EGFR野生型和c-MET阳性的晚期NSCLC患者。对于EGFR突变NSCLC患者,一种靶向EGFR和HER3的双特异性抗体偶联药物BLB01D1,展现出具有希望的治疗前景。在一项纳入既往平均接受过3次治疗的EGFR突变NSCLC患者中,接受BLB01D1治疗的患者客观缓解率可达到62%。
新型疗法
(1)新型免疫疗法的研究重点是单一疗法和组合疗法。相关3期临床研究正在探索其他可用靶点,如TIGIT、TIM3(HAVCR2)和LAG3,目的是增强肿瘤免疫反应。
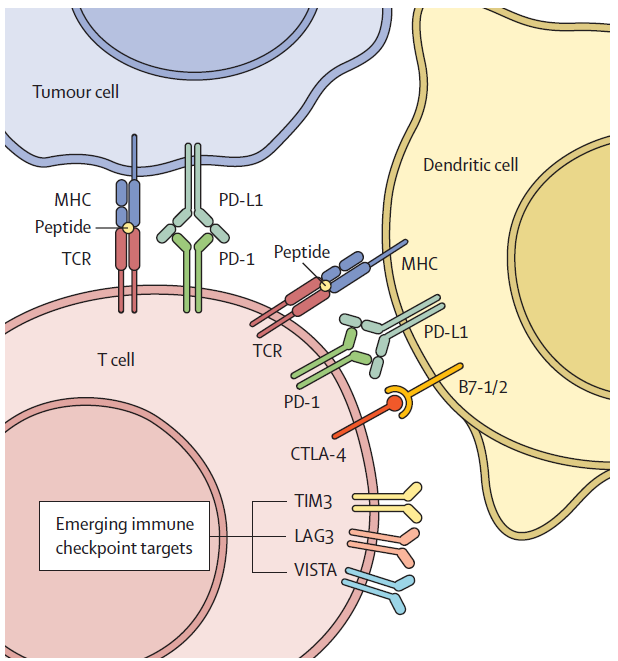
▲免疫检查点抑制剂相关靶点(图片来源:参考文献[1])
(2)其他临床研究还涉及TGFβ、IL-1β、PARP、VEGF、和cMET通路,这些通路均与癌症恶性表型和进展密切相关。
(3)此外,也有研究在探索针对免疫靶标或T细胞增殖物的双特异性或三重特异性疗法,癌症疫苗和T细胞工程的应用机会也有所增加。
(4)嵌合抗原受体T细胞(CAR-T)疗法已获批用于治疗血液恶性肿瘤,也同时在NSCLC等实体瘤中开展研究,但仍处于发展初期。
(5)肿瘤电场治疗(TTF)被获批用于治疗胶质母细胞瘤和间皮瘤,目前也在探索治疗NSCLC。一项纳入铂类治疗后病情进展NSCLC患者的3期试验结果显示,对于接受免疫治疗、但未采用标准一线ICI的患者,增加肿瘤电场治疗可增加患者总生存期。
小结
靶向治疗和免疫治疗已然改变了NSCLC的治疗格局,但也存在耐药性增加、部分患者代表性不足等挑战,临床需要解决相关问题,制定新的治疗策略,以增加患者的可选择治疗方案。未来通过对生物标志物的认识加深,可以找到更适合某种疗法的患者,这对于提高疗效和安全性非常重要。此外,我们也仍需时刻关注临床创新疗法进展,加强学科合作,采用综合治疗措施,积极推动对NSCLC的治疗。
参考资料
[1] Meyer, May-Lucie et al.New promises and challenges in the treatment of advanced non-small-cell lung cancer. The Lancet, Volume 404, Issue 10454, 803 - 822
作者:医学新视点
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#NSCLC# #肺癌#
21