Nat Commun:北京大学周菁团队发现内皮细胞DDR1感知血流扰动而促进动脉粥样硬化
2023-10-14 论道心血管 论道心血管
该研究首次发现并证明了RTK家族中的盘状蛋白结构域受体1—DDR1可以充当内皮细胞中的直接力学感受器,并通过单分子磁镊技术解析了DDR1在力学刺激后发生构象改变的关键结构域。
血管内皮细胞持续暴露于复杂血流所构成的流场,如动脉主干长直部的层流和弯曲、分歧处的扰流,而分别具备了抵御粥样硬化发生的抗炎、抗异常增殖、抗氧化和凋亡表型,以及对粥样硬化易感的促炎、促增殖、促氧化反应表型。内皮细胞中的力学感受器作为对胞外力学信号的“第一响应者”,负责将复杂流场所传递的力学信号转化为细胞内的生物化学信号,影响内皮细胞的功能和表型。
目前已经有许多力学响应元件被报道,主要包括糖萼、初级纤毛、小凹蛋白、GPCR、离子通道、酪氨酸激酶受体(RTKs)、细胞间连接蛋白复合物和整合素等。然而,尽管这些蛋白和结构被证明能够对血流剪切力做出反应,但是,支持其中的大多数能直接和独立感知剪切力的证据并不充分。力学感受器的发现和确认以及解析其力学感知的结构基础对治疗心血管疾病具有重要意义。
2023年10月13日,北京大学医学部基础医学院生理学与病理生理学系周菁课题组与中科院生物物理研究所李伟课题组合作在Nature Communications杂志在线发表了题为“Endothelial Discoidin Domain Receptor 1 Senses Flow to Modulate YAP Activation”的研究论文。该研究首次发现并证明了RTK家族中的盘状蛋白结构域受体1—DDR1可以充当内皮细胞中的直接力学感受器,并通过单分子磁镊技术解析了DDR1在力学刺激后发生构象改变的关键结构域。

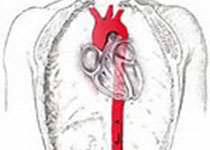
课题组前期工作(Bioactive Materials 2022, Circulation Research 2023)中曾证明了DDR1可以充当血管平滑肌细胞中基质刚度的感受器,DDR1可以在基质刚度的刺激下发生“液-液”相分离(LLPS),以时空受控的方式调控下游信号转导途径。研究证实了DDR1在cell-free系统中、在细胞内、在组织中均有形成液态凝聚体的能力。然而,DDR1能否介导内皮细胞对血流剪切力的响应尚不清楚。为了探究这一问题,研究者首先通过平行板流动腔模型进行了体外细胞实验,其中脉动剪切力(PS)用来模拟层流,振荡剪切力(OS)用来模拟扰流。结果发现,敲低DDR1显著抑制了内皮细胞在PS作用下沿血流方向的排列。更令人兴奋的是,研究者在本身不表达DDR1的NIH3T3成纤维细胞中引入DDR1表达,然后对其施加血流剪切力,结果发现DDR1赋予了NIH3T3细胞沿血流方向排列的能力。此外,敲低DDR1显著抑制了PS诱导的抗炎转录因子KLF2和KLF4的表达,以及OS诱导的促炎基因表达上调,证明DDR1参与了内皮细胞对血流剪切力的功能响应。为了在体内证明这一点,研究者构建了内皮特异性Ddr1敲除小鼠,对其进行了左颈动脉部分结扎,3天后通过尾静脉注射AAV8-PCSK9病毒,并给予高胆固醇饮食以诱导动脉粥样硬化。结果显示,与对照组相比,Ddr1iECKO小鼠血管内膜E-selectin和VCAM1等粘附分子表达显著降低,动脉粥样硬化斑块面积显著减少。以上结果证明,DDR1介导了内皮细胞对血流剪切力的响应。
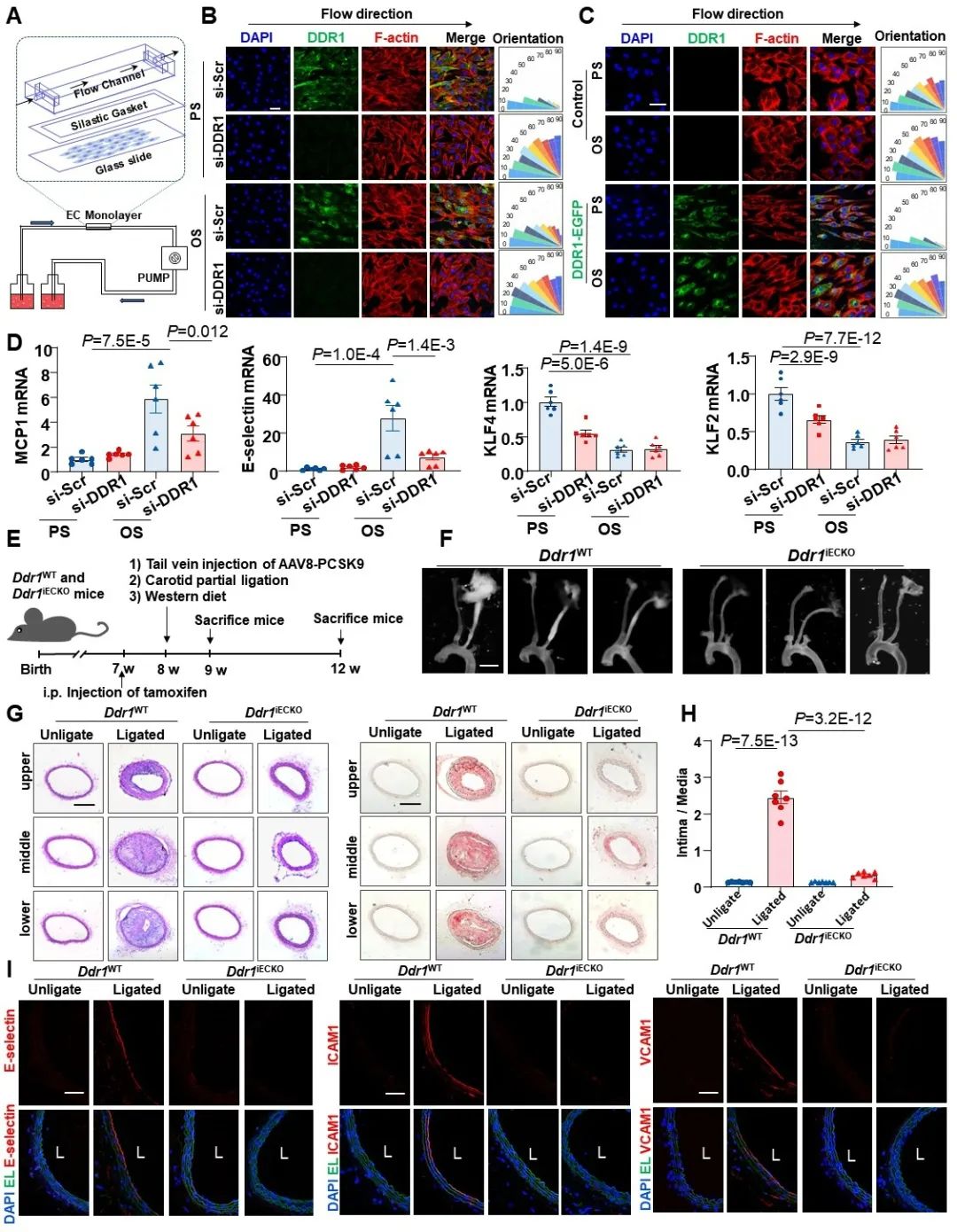
图1. DDR1介导了内皮细胞对血流剪切力的响应
接下来,研究者进一步探究了DDR1是否会在血流剪切力的作用下激活。研究者的前期研究表明,DDR1的活化主要表现为其寡聚化、磷酸化以及凝聚体形成。研究者首先通过免疫荧光检测了剪切力诱导的DDR1凝聚体形成。在PS作用下,DDR1凝聚体的形成是快速而短暂的(1h后逐渐减弱);而在OS作用下,DDR1凝聚体形成则更为缓慢且持久(可持续24h以上)。接下来,研究者通过非还原性电泳检测了DDR1的聚集状态,同样发现PS在1h内迅速增加了DDR1寡聚化状态所占的比例,而OS对DDR1寡聚化的诱导是逐渐增加的(约3h能检测到)。此外,DDR1磷酸化状态的检测结果也与上述一致。为了实时观察剪切力诱导的DDR1凝聚体形成,研究者还通过微流控模型对内皮细胞进行了活细胞成像,结果发现,层流可以在非常短的时间(大约十几秒内)激活DDR1,而扰流则需要更长的时间才能诱导DDR1凝聚体形成。此外,研究者还通过活细胞3D成像技术,发现层流诱导的DDR1凝聚体主要位于内皮细胞顶面,这说明DDR1可以直接受到管腔中血流剪切力的作用。
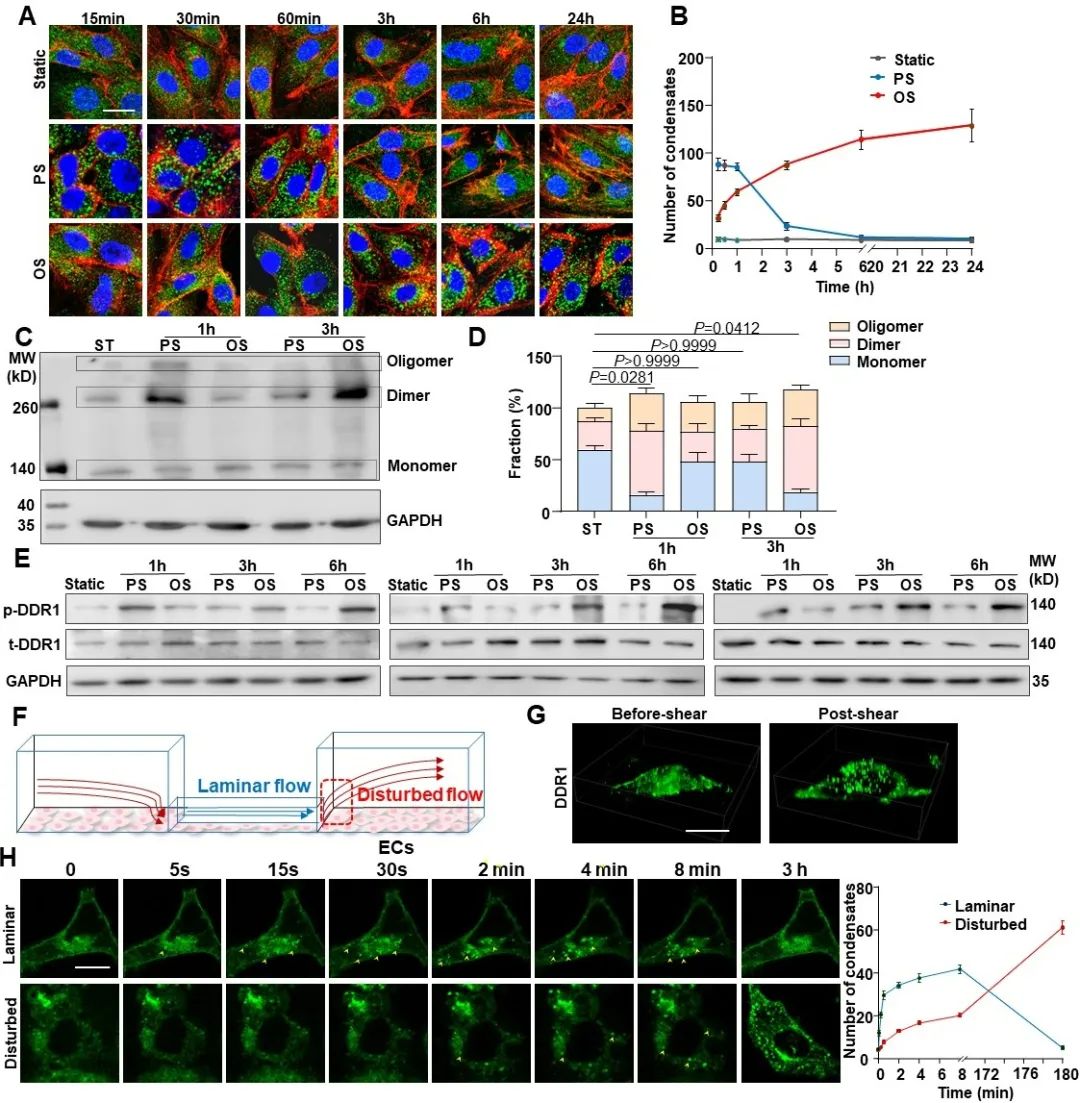
图2. 血流剪切力诱导了DDR1的凝聚体形成和活化
那么,DDR1是否可以直接感受机械力呢?为了回答这个问题,研究者通过与中科院生物物理所的李伟老师合作,设计了一系列磁镊相关实验。首先,研究者通过包被DDR1配体或者抗体的磁珠对内皮细胞表面的DDR1蛋白特异性地施加一个pN级的拉力(不造成细胞膜的形变),然后观察DDR1能否被激活。结果显示,在包被胶原蛋白或者DDR1抗体的磁珠的牵拉下,内皮细胞中的DDR1均会在磁珠周围发生明显的簇集,而对照组则无此现象。此外,已有研究表明RTK的活化会引起钙内流的增加,研究者用钙探针检测了磁珠牵拉下内皮细胞中的钙响应,同样在实验组观察到了非常明显的钙内流。这些结果均证明了DDR1在力作用下的活化。为了探究DDR1在血流剪切力作用下的活化机制,研究者通过基于荧光共振能量转移(FRET)技术的膜张力探针对细胞膜张力进行了可视化。结果显示,在层流作用的1 min内,细胞膜被拉伸,膜张力增加,DDR1凝聚体数量也显著增加;而当停止施加剪切力后,在膜张力逐渐恢复的同时,DDR1的凝聚体也逐渐减少。接下来,研究者通过给细胞膜增加胆固醇来降低膜流动性。结果发现,膜流动性的降低显著抑制了血流剪切力诱导的DDR1活化,说明DDR1的活化与剪切力诱导的膜张力变化有关。以上结果共同证明了DDR1是内皮细胞中直接的力学感受器。
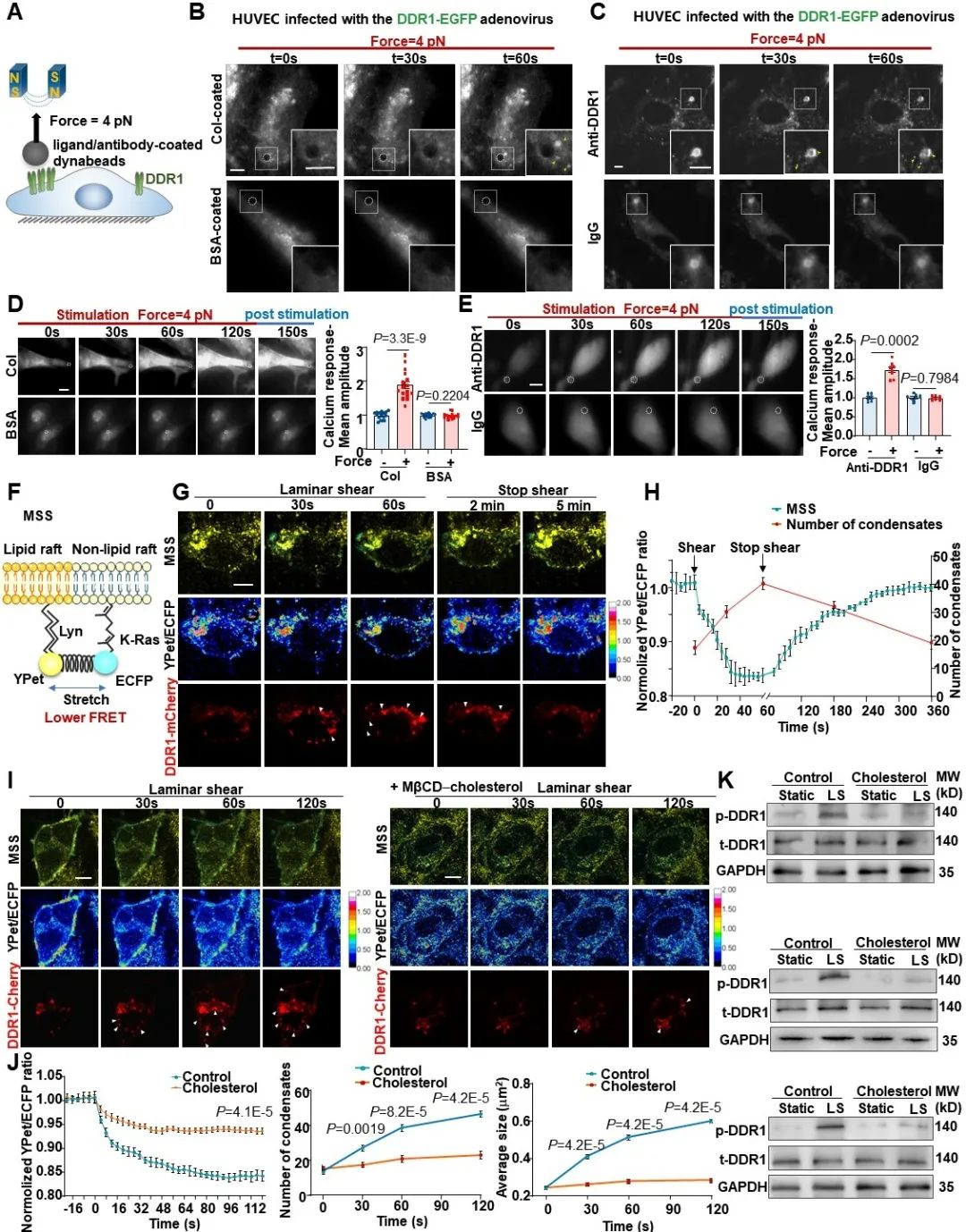
图3. DDR1是内皮细胞中直接的力学感受器
那么,DDR1究竟是如何感知并响应力学信号的呢?从结构上来看,DDR1是单次跨膜蛋白,由胞外域、跨膜域和胞内域三部分组成,其中胞外域是最可能在血流剪切力作用下发生构象改变的。于是,研究者通过单分子磁镊技术对DDR1胞外域的解折叠动力学进行了研究。单分子磁镊结果显示,当不施加剪切力时,DDR1解折叠所需的拉力平均为20.7 pN,其跳变的长度大约为48 nm。而当研究者预先施加一段时间剪切力后再进行拉伸实验,DDR1的解折叠力显著降低到了约5.5 pN,而解折叠的长度几乎不变。这一结果表明,剪切力可能使DDR1胞外域处于一个对机械力更敏感的状态。DDR1的胞外域主要由DS结构域、DS-like结构域以及一段近膜结构域组成。通过计算可知,磁镊实验所得解折叠长度正好对应预期的DS-like结构域的解折叠长度。为了证明DS-like结构域的开放构象对其力学响应的重要性,研究者通过双半胱氨酸突变形成二硫键,从而将DS-like结构域的N端和C端进行了锁定。接下来,研究者将DS-like锁定突变体转染到了内皮细胞中,发现其几乎完全不能响应于血流剪切力,并且对胶原蛋白的响应也大大降低。此外,DS-like结构域的锁定也显著损害了DDR1的寡聚化。以上结果表明,DS-like结构域的开放构象对DDR1的力学响应十分重要。
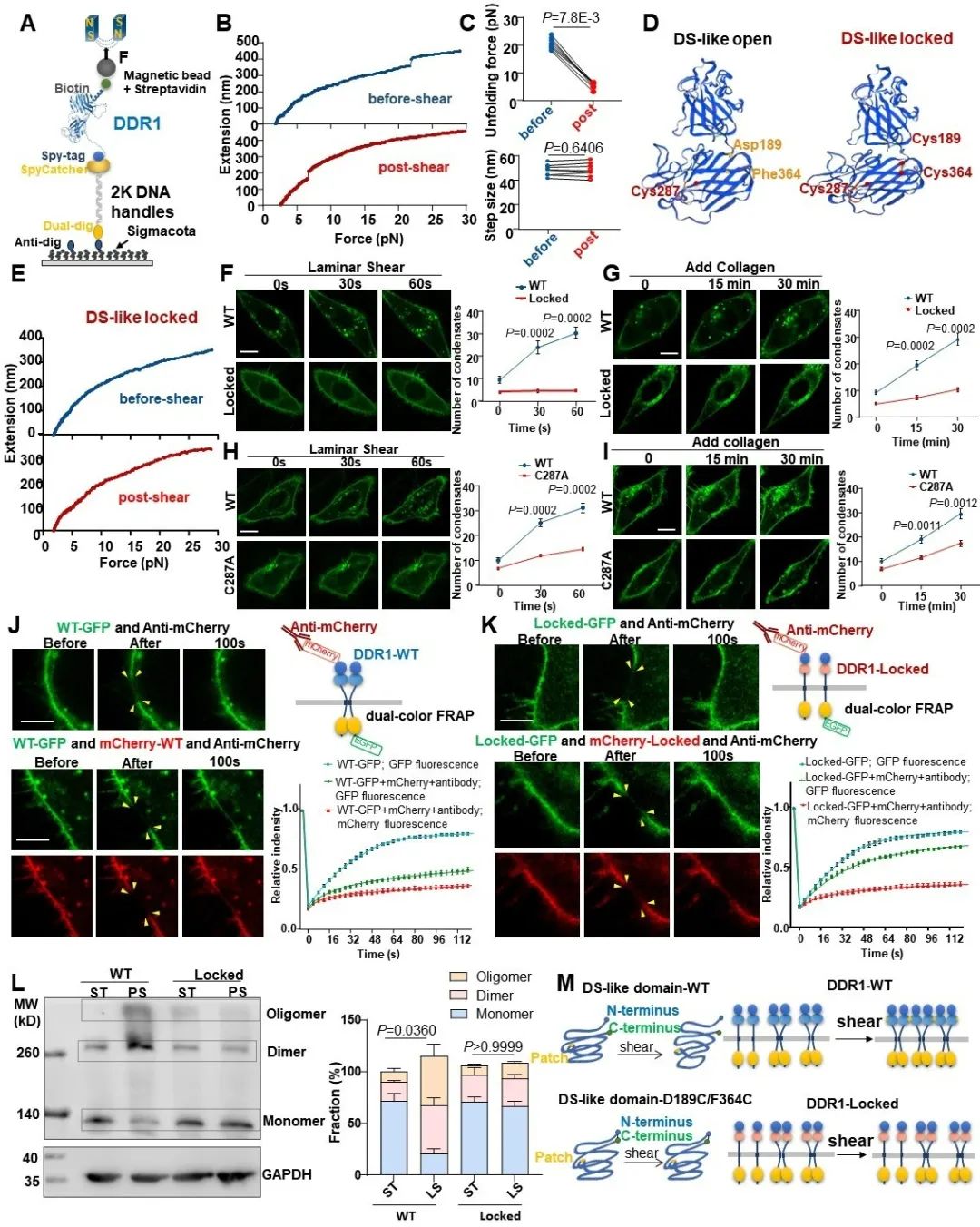
图4. DS-like结构域的开放构象对DDR1的力学响应至关重要
接下来,研究者使用免疫共沉淀联合质谱技术,探究了DDR1会与哪些下游蛋白相互作用。研究者一共筛选出64种在OS/PS条件下与DDR1结合显著变化(OS/PS>1.25或<0.75)的蛋白质,其中17种可以通过蛋白相互作用预测网站PRISM预测出其与DDR1的直接结合位点。通过对这些蛋白进行蛋白相互作用网络分析,研究者关注到了位于此蛋白网络的中心位置的YWHAE(14-3-3ε)蛋白。更令人惊喜的是,14-3-3蛋白家族还被报道可以调控其结合伴侣的液-液相分离。通过光激活的Optodroplets系统,研究者发现单独的YWHAE不具备相分离的能力,但其可以与DDR1发生共同相分离。体外相分离实验表明,YWHAE可以与DDR1的C端而不是N端发生共同相分离,并且在一定的范围内可以促进DDR1的凝聚体形成。此外,通过蛋白相互作用位点预测和点突变实验,研究者进一步证明了DDR1的K674位点和YWHAE的Y214位点在两者的结合中起到了关键作用。
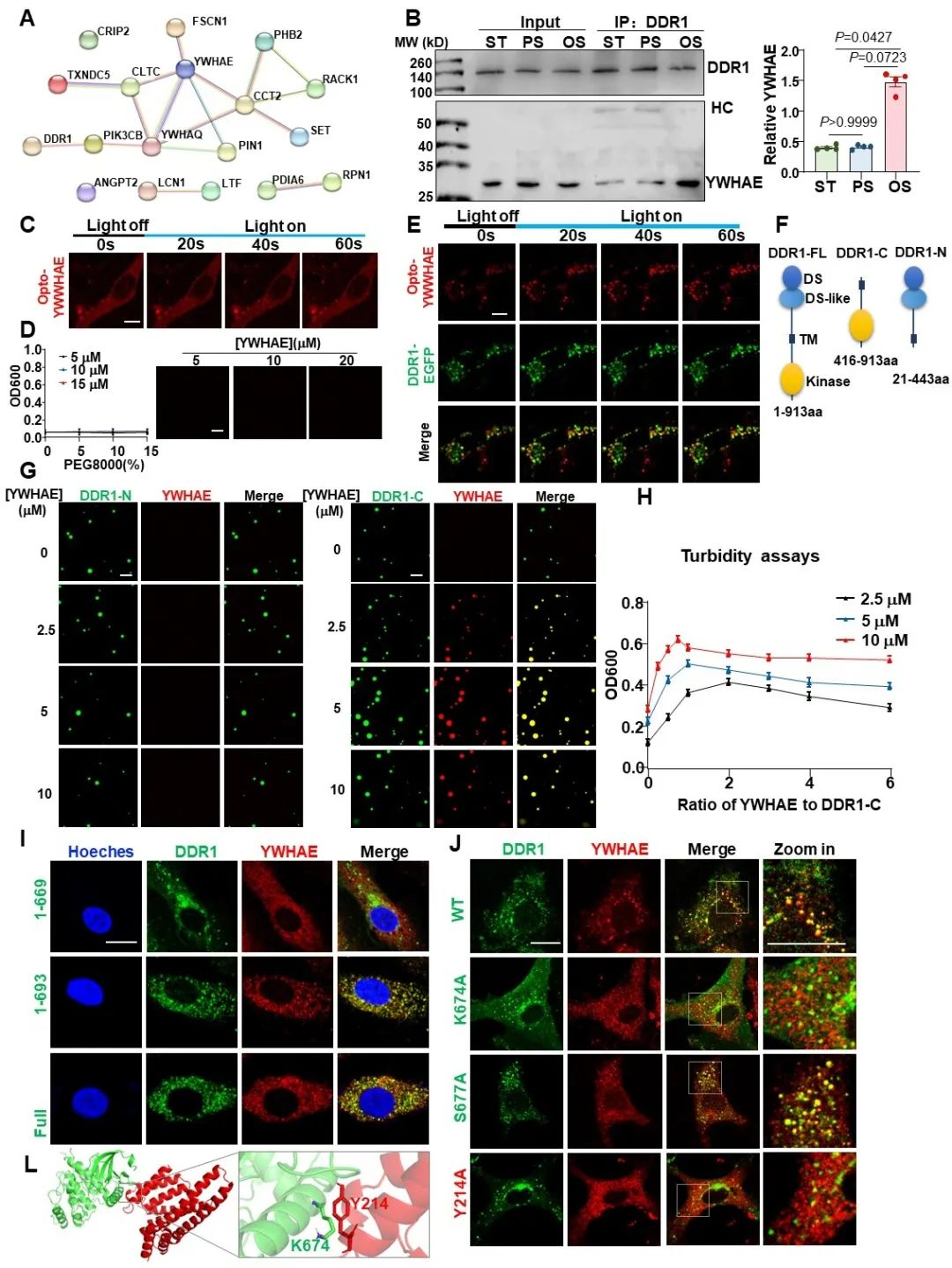
图5. 剪切力可以诱导YWHAE与DDR1发生共同相分离
由于14-3-3蛋白可以介导磷酸化YAP的降解和失活,研究者进一步探究了DDR1-YWHAE信号通路是否调控了扰流作用下YAP的入核。首先,研究者发现DDR1抑制剂可以显著抑制扰流下YAP的入核和去磷酸化,说明DDR1介导了扰流诱导的YAP活化。接下来,研究者在抑制DDR1的基础上,又叠加敲低了YWHAE,发现YAP的入核和磷酸化被显著逆转,说明DDR1-YWHAE信号轴的确调控了扰流诱导的YAP活化。
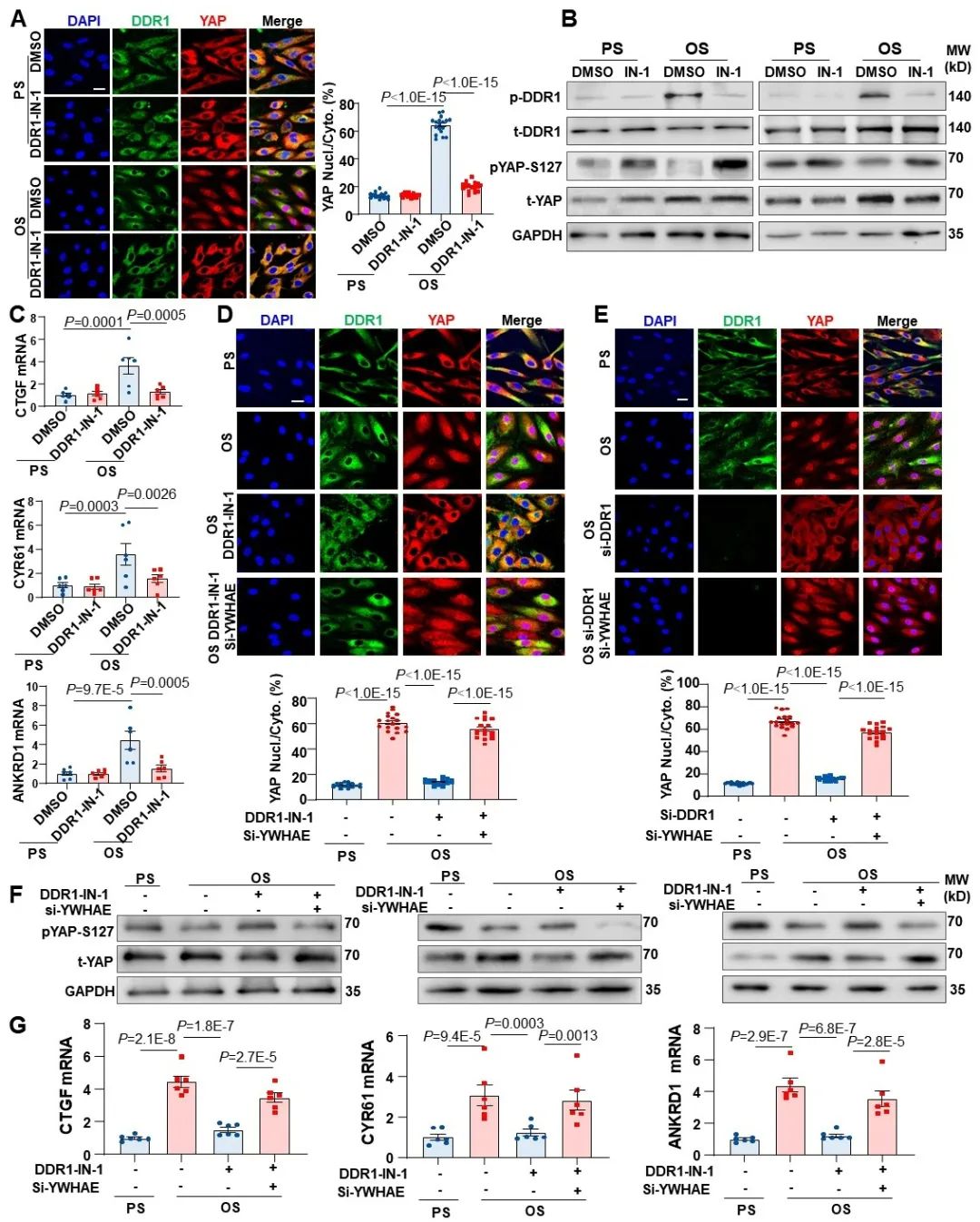
图6. DDR1-YWHAE信号轴介导了扰流诱导的YAP活化
综上所述,本研究证明了DDR1是内皮细胞中关键的力学感受器,并解析了DDR1在力学作用下发生构象改变的关键结构域。在分子机制上,活化的DDR1可以与14-3-3ε共同相分离,从而促进了YAP的稳定性和入核,进而促进了动脉粥样硬化的发生发展。
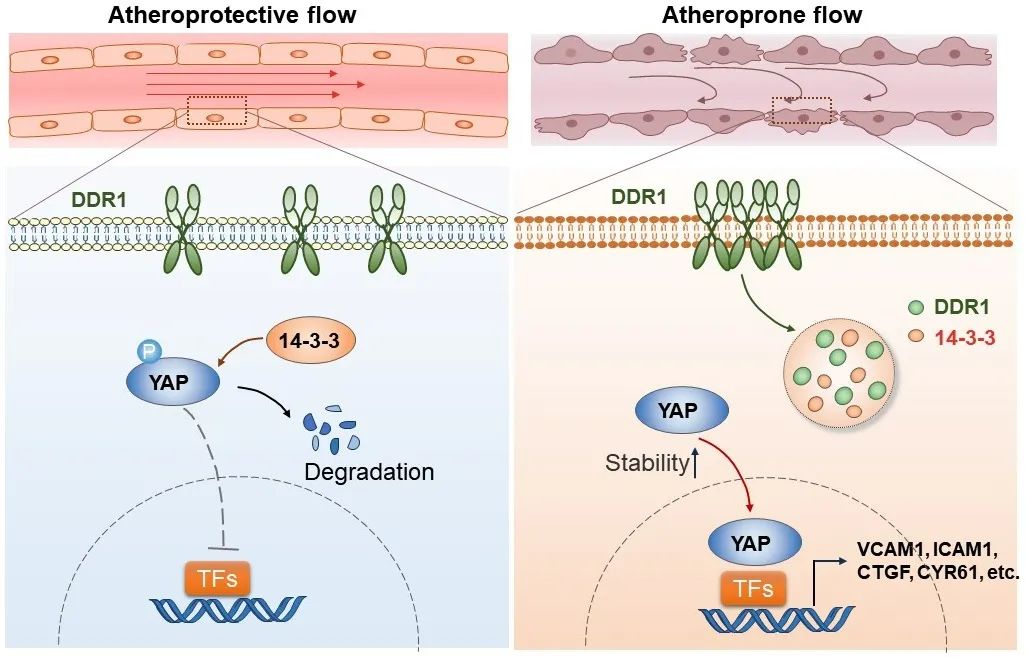
图7. DDR1感知不同模式的流体剪切力,以受体相分离启动机械信号转导,调控YAP活化
北京大学基础医学院生理学与病理生理学系博士生刘佳钰和博士后赵川榕为该论文的共同第一作者,北京大学生理学与病理生理学系周菁研究员和中科院生物物理研究所李伟研究员为共同通讯作者。感谢大连理工大学李波教授提供的膜张力FRET探针,感谢北京大学生理学与病理生理学系张炜真老师在脂肪组织代谢测量方法上提供的建议。项目得到国家自然科学基金委员会等机构的资金资助。
全文链接:
https://www.nature.com/articles/s41467-023-42341-z
作者:论道心血管
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言