Cancer Cell:新型肿瘤治疗靶点被发现!或将改写癌症治疗格局!
2019-01-28 Paris 转化医学网
来自加利福尼亚大学圣地亚哥医学院的科学家,通过检测干细胞酶ADAR1基因,为癌症的早期检测提供一种检查靶点,用于癌症的早期检测,并为癌症治疗提供靶点。
在人类对癌症对抗的战争中,免疫治疗和基因治疗从中脱颖而出,其二者可谓是战功赫赫,而纵观如今已经取得爆发式增长的基因编辑领域,RNA编辑绝对是黑马中的黑马,2017年, W. Nicholas Haining团队通过CRISPR技术对潜在的免疫治疗新靶点进行了大规模筛选,鉴定出了很多与肿瘤免疫相关的基因,在这些基因中,有一个叫ADAR1的基因表现尤为突出。当将肿瘤的ADAR1基因敲除后,耐药的肿瘤便能响应免疫治疗药物了。
ADAR1基因不仅在免疫领域贡献突出,其在基因编辑领域同样有不菲的成绩。来自加利福尼亚大学圣地亚哥医学院的科学家,通过检测干细胞酶ADAR1基因,为癌症的早期检测提供一种检查靶点,用于癌症的早期检测,并为癌症治疗提供靶点。该研究以“Hyper-Editing of Cell-Cycle Regulatory and Tumor Suppressor RNA Promotes Malignant Progenitor Propagation”发表在《Cancer Cell》杂志上,进一步推动了RNA编辑的发展。
在每个健康的人类细胞中,编码于DNA的遗传信息会被转录到信使RNA,转而被翻译成作为所有人体组织和器官(运转)主力的蛋白质。多数观点认为大部分恶性肿瘤都是由DNA突变造成的,这些突变会导致相应蛋白产物的异常激活或失活,并导致后续肿瘤细胞失控性的生长和增殖。
RNA编辑是转录后RNA序列的突变被引入的过程,它具有影响多种细胞过程的潜能,然而至今(人们)对其如何影响的具体机理还知之甚少。
先前的研究显示基因组中有超过一百万个位点被不同程度地编辑过。尽管事实上这些编辑位点的大多数落在不翻译成蛋白质的区域,但它显示了肿瘤和正常组织在RNA编辑水平上的差异与不同的临床检查结果有关。
目前,只有少数编码RNA的编辑位点被功能性地描述过其特征。不过,这些在非翻译区域的大多数RNA编辑事件是否以及如何影响肿瘤的生长仍然是一个谜。
腺苷脱氨酶是由ADAR基因编码的三个酶家族,代表腺苷脱氨酶对RNA的作用。它们通过修饰双链RNA分子中的核苷酸来调节基因的表达,在新的干细胞的发育过程中起着基础编辑的作用。

然而,ADAR1基因其实是一把双刃剑,不仅在干细胞的发育过程发挥影响,也能在像肝癌、乳腺癌和白血病这样的癌症中被激活。由高级作者、医学博士、桑福德干细胞临床中心副主任、加州大学圣迭戈摩尔斯癌症中心副主任卡特里奥娜·贾米森领导的研究小组发现,ADAR1酶的正常功能被恶性肿瘤细胞劫持,导致细胞恶性转化、促进休眠癌症干细胞的产生并抵抗治疗。
之前已有研究表明,与RNA1(ADAR1)相关的腺苷脱氨酶的释放参与了许多恶性肿瘤的耐药。ADAR1基因编码的ADAR1蛋白是一个双链RNA(dsRNA)编辑酶,它能将dsRNA上的腺嘌呤(A)转化为次黄嘌呤(I),而次黄嘌呤又会被“误”认作鸟嘌呤(G)。也就是说,ADAR1蛋白具有改变dsRNA序列的作用。
当dsRNA被一些感知蛋白(如PKR、MDA5等)识别后,这些蛋白在IFN的刺激下,会激活大量基因的表达,引发免疫反应。但是,如果dsRNA的序列被ADAR1蛋白改变,则可能使识别蛋白无法再感知它们,进而就无法激活相关的基因表达了。简单来说,就是ADAR1蛋白会阻断IFN信号通路。
然而,和PD-1和CTLA4这两个免疫检查点一样,ADAR1蛋白的这种免疫调节功能可能被肿瘤利用。
因为IFN信号通路在肿瘤免疫中也发挥着重要作用。IFN能激活NK细胞的毒活性,激活肿瘤特异性T细胞,诱导T细胞释放穿孔素、颗粒酶等杀伤肿瘤细胞,增强抗原呈递作用等等。
若IFN信号通路被阻断,肿瘤就可能抵抗免疫系统的攻击,使得免疫治疗失效。
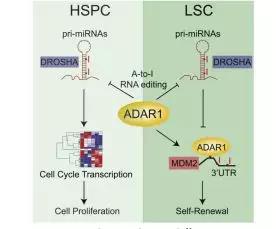
在此次的研究中,我们发现,在正常的人类造血祖细胞中,ADAR1诱导的超编辑损害了miR-26a的成熟,并通过EZH2间接抑制了CDKN1A的表达,从而加速了细胞周期的转变。
然而,在急变期慢性粒细胞白血病祖细胞中,EZH2的表达缺失和CDKN1A的增加会抑制细胞周期转运,从而控制恶性肿瘤细胞的快速增殖。这为癌症早期的检测和治疗提供了另一种思路。通过对ADAR1基因进行检测不仅可以发现早期癌症,还可通过靶向敲除ADAR1基因来恢复癌症治疗敏感性,这简直是意外之喜!
RNA编辑时代已经到来,此次研究结果将进一步调整基因编辑领域的蓝图,攻克癌症之路路途遥远,但我们从未停止进步,让我们再接再厉,共同攻克一步步难关!
原始出处:Jiang Q1, Isquith J2, Zipeto MA2, et al. Hyper-Editing of Cell-Cycle Regulatory and Tumor Suppressor RNA Promotes Malignant Progenitor Propagation. Cancer Cell. 2019 Jan 14;35(1):81-94.e7.
作者:Paris
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#治疗格局#
47
#cancer cell#
40
#CEL#
35
#癌症治疗#
38
#Cell#
38