导读
几十年来,癌症一直是导致人类死亡的主要原因,因此预防癌症或及早发现癌症并以最小的代价治疗癌症迫在眉睫。在“Cancers make their own luck: theories of cancer origins”这篇综述中,作者讨论了癌症起源的主要理论以及支撑这些理论的因素的相对重要性。
癌症起源的主要理论主要有以下四种:1、体细胞突变理论;2、癌症组织结构理论;3、“厄运”理论;4、“基态”理论。前三个理论都是从单一维度阐述了癌症的起源,作者提出的第四个“基态”理论从多维度探讨了癌症的起源,认为癌症是由细胞内在因素和外部因素共同作用产生的,这些因素一起形成了驱动癌症形成的细胞状态。
在基态理论中,癌症发生的内在因素包括细胞身份、表观遗传变化和DNA突变三个方面。作者以儿童髓母细胞瘤为例表明细胞的身份或其原始特性可能是决定癌症风险的关键因素,表观遗传变化是指在基因的DNA序列没有发生改变的情况下,基因功能发生了可遗传的变化,并最终导致了表型的变化,其也是癌症风险的主要决定因素。
癌症长期以来一直被认为是一种基因组疾病。目前来源于数千对人类癌症测序的研究表明,肿瘤平均会获得四到五个“驱动”突变,并且这种突变会随着年龄的增长而增加。其实生理上正常的组织可以耐受大量的致癌突变,甚至这种突变克隆的积累很可能是有益的,甚至是老化上皮的“正常”特征,食管中这种克隆的出现已被证明可以通过细胞竞争清除早期肿瘤,从而保持组织完整性。由此可知,尽管癌症发生过程中的DNA变异是不可逆的,但表观遗传变化是可逆的,调节表观遗传变化有可能为肿瘤防治打开一扇窗(Nat Rev Cancer. 2023 Jul 24. doi: 10.1038/ s41568-023-00602-5)。
引言
几十年来,癌症一直是导致死亡的主要原因,因此预防癌症或及早发现癌症迫在眉睫。因为此时的治疗创伤较小、费用相对较低,而且更有可能治愈。但是,肿瘤组织究竟是如何发生转化的,仍然存在争议,这阻碍了癌症预防和早期干预策略的实施。关于癌症的起源出现了各种理论,包括 “运气不好 ”的说法:增殖干细胞随机突变的必然结果。在本综述中,讨论了癌症起源的主要理论以及支撑这些理论的因素的相对重要性。现有证据表明,发育中和老化中的组织 “走钢丝”,既要保持足够水平的细胞可塑性来产生和维持组织,又要避免过度转化。与其将癌症视为 “厄运”,不如了解细胞内在和外在因素的复杂编排,这些因素是转化的特征,有望发现有效的新方法,在癌症变得不可治愈之前预防、发现和阻止癌症。
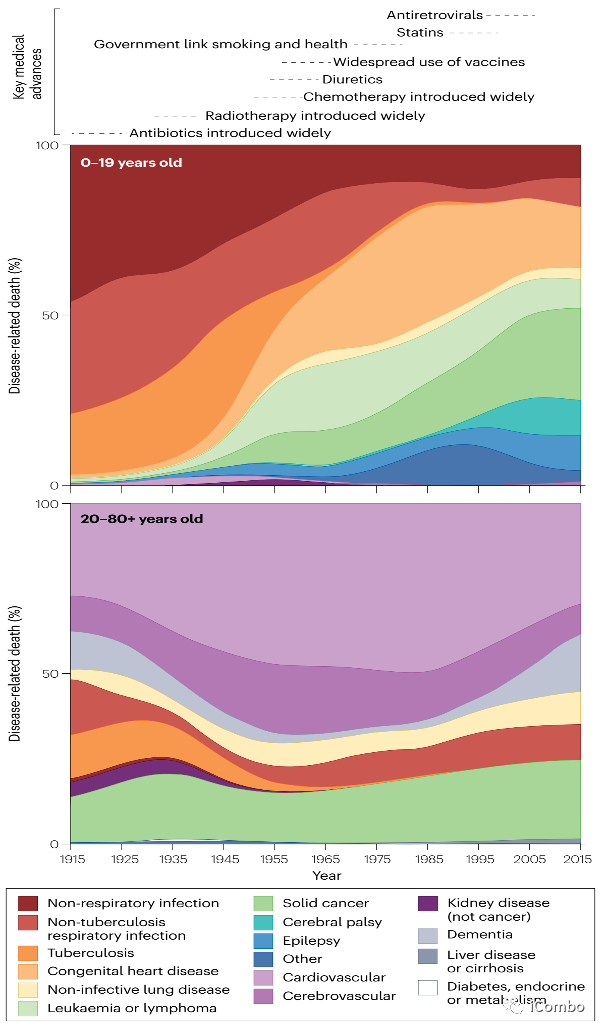
Fig. 1 | Major causes of disease-related death.
癌症是细胞内外因素共同作用的结果!
01 细胞身份
了解癌症起源的一个基本要素是确定每种组织中可以发生恶性转化的细胞的身份。由于许多白血病和实体肿瘤都具有分层组织结构,并由一部分自我更新的细胞亚群维持,因此干细胞(或已获得干细胞样功能的细胞,例如,在组织损伤后)被认为是大多数组织中癌症的起源。

Fig. 2 | Organ sites of common human cancers.
流行病学和功能研究表明,癌症并不仅仅是干细胞随机突变的结果。细胞的身份或其原始特性可能是决定癌症风险的关键因素。散发性癌症中特定组织的突变模式以及遗传性癌症综合征中特定器官的肿瘤形成模式表明,细胞对转化的敏感性不同,不同的组织被不同的致癌突变转化。比如皮肤细胞可能会因暴露于紫外线而转化为癌细胞,而吸烟可能会导致肺癌的发生。
肿瘤的表型取决于特定的致癌病变以及起源细胞(即本文提到的细胞身份)
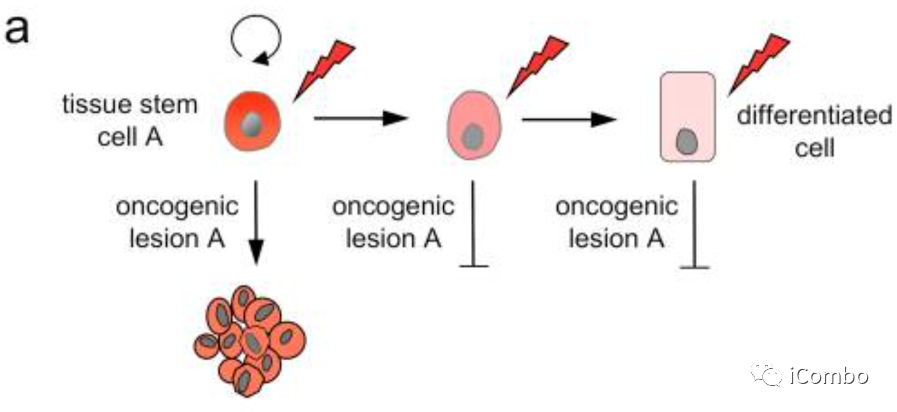
干细胞对特定的致癌事件敏感
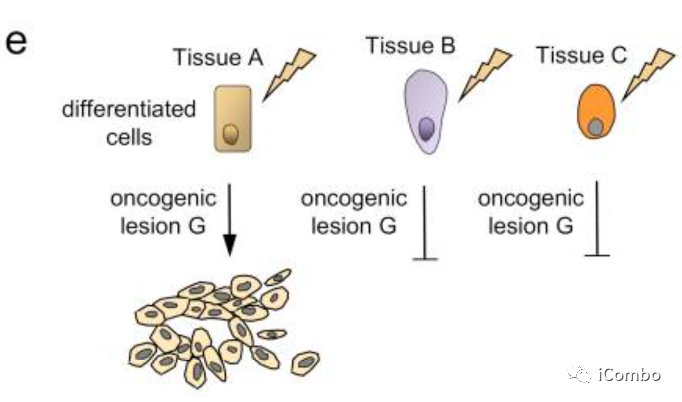
只有在特定组织类型中的分化细胞(但在大多数其他细胞中不是)易受癌症驱动因子
关于细胞环境如何决定患某些癌症的风险,最清楚的例子是儿童恶性肿瘤。
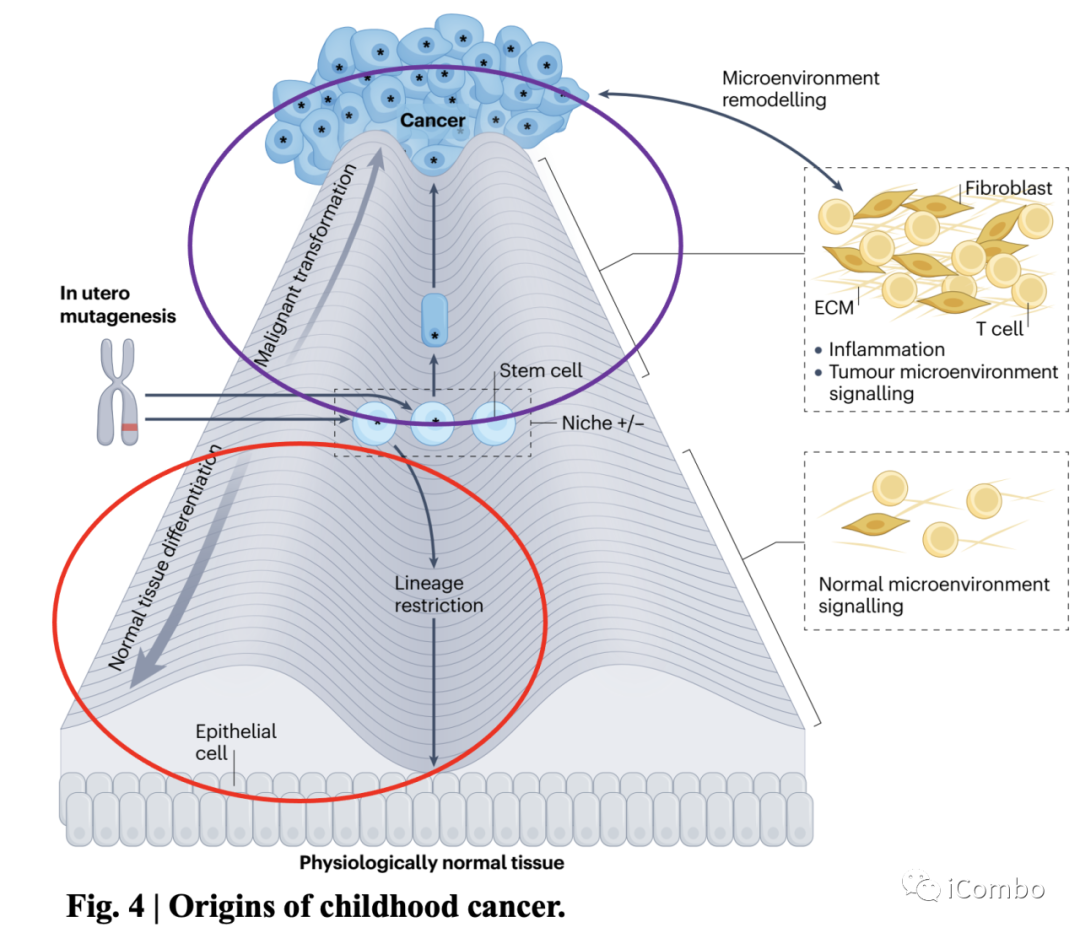
Fig. 4 | Origins of childhood cancer.
不同类型的组织干细胞存在于各自的小环境中,在转化过程中可能起到积极和消极(+/-)的作用;
体细胞突变通常是通过宫内突变获得的,有些干细胞类型可耐受突变,这些干细胞经历了谱系限制的分化,形成了生理上正常的组织,且这一过程得到了正常微环境信号的支持;
另外一些干细胞的基态容易受到这种特定突变驱动的癌症的影响,从而启动转化;
由于新生儿干细胞对癌症的抵抗力相对较强,转化之路相对较为艰难,转化细胞和微环境之间的信号重塑并促进这一过程和癌症表型;
所以起始细胞的身份是癌症风险的关键决定因素,这也并不排除肿瘤可能是干细胞的随机突变导致的可能性。
儿童期癌症通常不会在成年人中发现,因为它们起源于仅在胚胎中发现的祖细胞,有些不能在小鼠中建模,因为它们起源于人类特异性祖细胞。

髓母细胞瘤(MB)由一组异质性的小儿后脑胚胎性肿瘤组成,与后脑的早期发育密切相关,被定性为一种单一类型的癌。
大量的研究完善了髓母细胞瘤的基因图谱,将该疾病分为四个亚组。其中两个亚群的遗传原因和细胞起源已经确定(分别称为Wingless(WNT)和Sonic hedgehog(SHH))。然而,对其余两组占了大多数病例的第3组和第4组的了解要少得多。
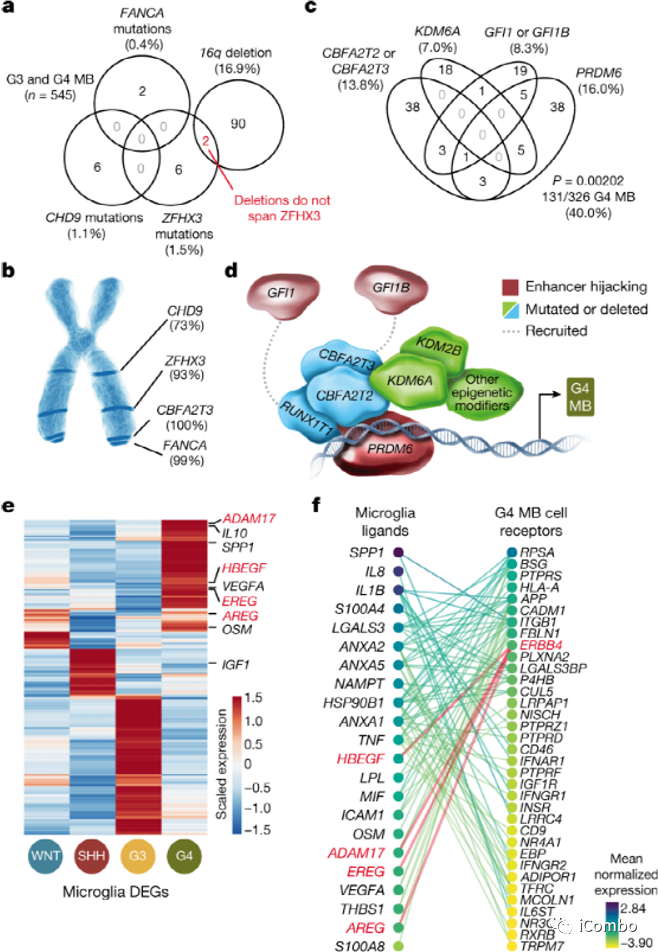
研究人员从世界各地的儿童医院收集了髓母细胞瘤样本,并使用测序技术来确定可能导致第4组髓母细胞瘤的遗传变异。
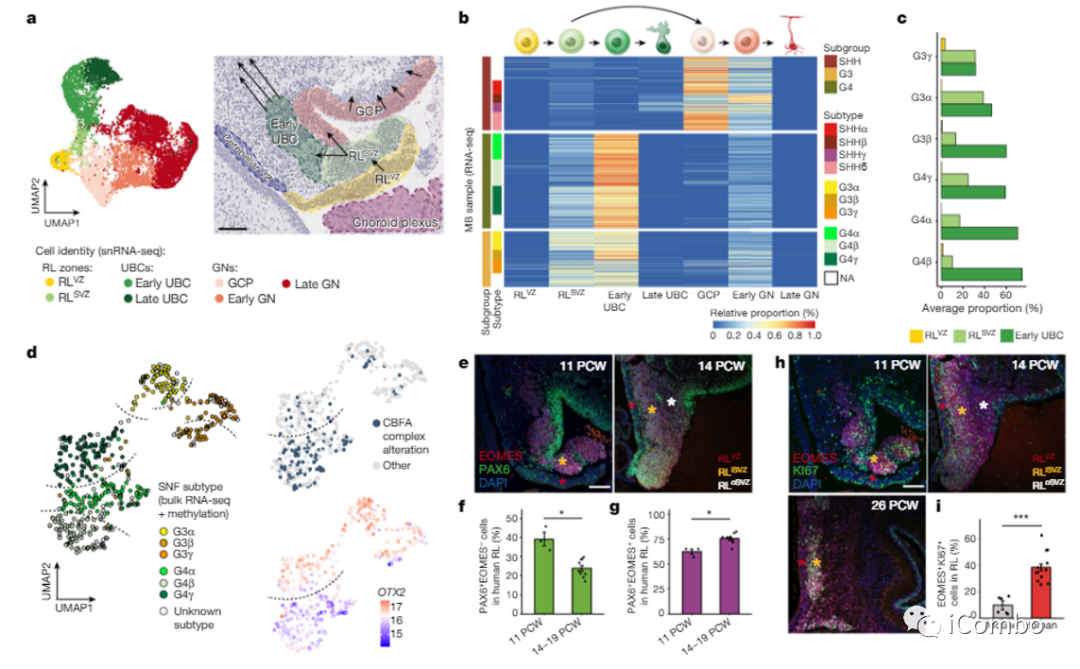
菱唇:是2014年公布的组织学与胚胎学名词。由后脑翼板背侧部增生扩展而成的唇状结构。小脑起源于此。
扩增后的人上菱唇( RL) 倾向于 G3和 G4 MB。
RL遗传变异“阻碍”了特定细胞类型中的正常细胞分化,这种分化仅存在于人类小脑的早期胚胎发育过程中。这种正常细胞分化的“停滞”导致了肿瘤的癌前形式,然后在出生后就存在于大脑中,这一发现可能也适用于其他形式的髓母细胞瘤。
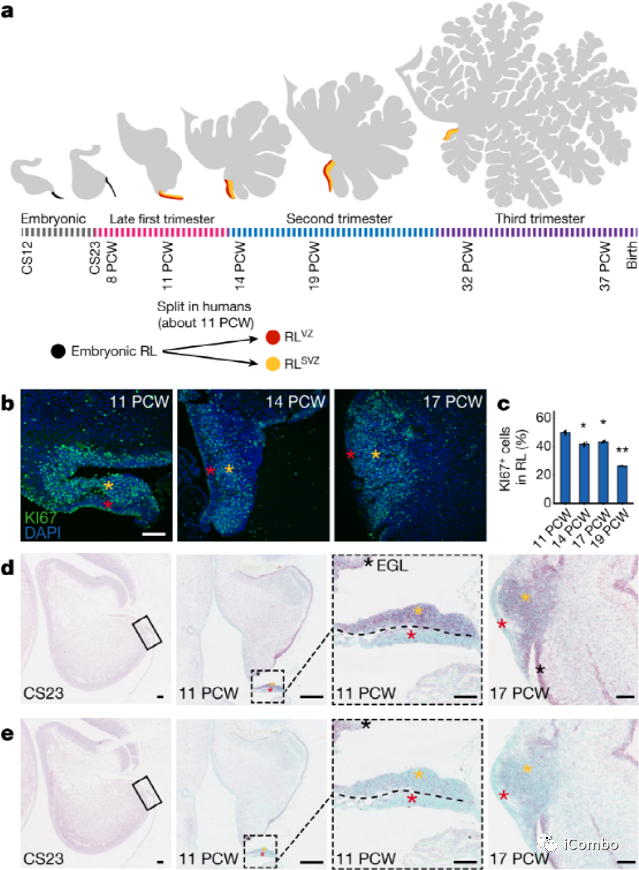
智人小脑发育示意图。
研究者取了不同周期的人体组织切片(PCW)。11PCW之前,上菱唇(RL)类似于小家鼠的RL。在大约11PCW时,人RL分裂成心室和室下区,这导致了人类特有的小脑扩张。
之后通过将髓母细胞瘤亚组特有的基因改变和分子特征与人类小脑发育的独特特征相结合,对这些问题进行了说明得出:
1、人类小脑发育过程中某一特定细胞群的分化缺陷,即产生称为上菱形唇室下区(RLSVZ)的祖细胞,是第3组和第4组髓母细胞瘤的来源。这些祖细胞产生了一组称为单极刷细胞的神经元。
2、人类中大量的单极刷状细胞祖细胞对我们这个物种构成了发展为第3组或第4组髓母细胞瘤的高风险。
文献的结果表明:一种只在发育中的人类大脑中发现的细胞类型即菱形唇室下区(RLSVZ)的祖细胞是这些肿瘤的起源。与其他哺乳动物相比,人类小脑的结构更为复杂。这可能意味着髓母细胞瘤是人类小脑进化复杂性的直接后果。
这表明人类胚胎菱形唇内独特的祖细胞群体可能使人类易于发展某些形式的脑髓母细胞瘤,而其他物种则不会。即某种特定的肿瘤来源可能是某一特定的“细胞类型”,并不是凭空产生的恶性肿瘤细胞。换言之,如果不存在某一特定的“细胞类型”,在其他细胞中发生同样的基因变化,人体也不会产生对应的肿瘤。
每一个“坏蛋”都有起源(细胞身份),当起源不存在时,“坏蛋”也就不复存在。
某些成人癌症类型:BRAFV600E突变发生在黑色素瘤中,其中肿瘤细胞表达神经嵴样转录切片,这表明这种发育状态能够转化。尽管在斑马鱼和人类多能干细胞模型中,BRAFV600E很容易转化神经嵴和成黑素细胞阶段,但黑素细胞相对具有耐药性。神经嵴细胞和黑色素母细胞的转化能力由SOX10转录因子和ATP酶家族AAA结构域含蛋白2(ATAD2)染色质因子的阶段特异性表达决定,它们共同促进祖细胞表型。事实上,ATAD2在黑色素细胞中的强制表达使其能够转化。
结合新生儿干细胞本质上对癌症的抵抗性的证据,强调起始细胞的身份是癌症风险的关键决定因素。这并不排除肿瘤可能是干细胞的随机突变导致的可能性,如“坏运气”理论所阐述的。
然而,由于不同的干细胞群体被不同的突变转化,即使是在同一组织内,而且干细胞在独立于增殖的转化易感性方面似乎表现出与年龄相关的差异,因此必须有额外的力量来确定特定细胞对特定突变的易感性。
02 表观遗传变化
两个概念:
经典遗传学(genetics):是指由于基因序列改变(如基因突变等)所引起的基因功能的变化,从而导致表型发生可遗传的改变。
表观遗传学(epigenetics):是指在基因的DNA序列没有发生改变的情况下,基因功能发生了可遗传的变化,并最终导致了表型的变化。
表观遗传学的特点:
-
可遗传,即这类改变通过有丝分裂或减数分裂,能在细胞或个体世代间遗传。
-
可逆性的基因表达。
-
没有DNA序列的改变或不能用DNA序列变化来解释。
表观遗传学包括:
1、DNA修饰
DNA甲基化是目前研究最充分的表观遗传修饰形式。正常的甲基化对于维持细胞的生长及代谢等是必需的,而异常的DNA甲基化则会引发疾病(如肿瘤),因为异常的甲基化一方面可能使抑癌基因无法转录,另一方面也会导致基因组不稳定。因此,研究DNA甲基化对于了解生物生长发育及疾病治疗是非常有帮助的。DNA修饰是指DNA共价结合一个修饰基团,使具有相同序列的等位基因处于不同修饰状态。
2、组蛋白修饰
真核生物DNA被组蛋白组成的核小体紧密包绕,组蛋白上的许多位点都可以被修饰,尤其是赖氨酸。组蛋白修饰可影响组蛋白与DNA双链的亲和性,从而改变染色质的疏松和凝集状态,进而影响转录因子等调节蛋白与染色质的结合,影响基因表达。
3、DNA修饰
RNA分子,在调控基因表达过程中发挥着很大的作用。非编码RNA调控是通过某些机制实现对基因转录的调控,如RNA干扰。非编码RNA指不能翻译为蛋白质的,具有调控作用的功能性。
4、染色质重塑
染色质重塑是由染色质重塑复合物介导的一系列以染色质上核小体变化为基本特征的生物学过程,是一个重要的表观遗传学机制。
5、核小体定位
核小体是基因转录的障碍,被组蛋白紧密缠绕的DNA是无法与众多转录因子以及活化因子结合的。因此,核小体在基因组位置的改变对于调控基因表达有着重要影响。随着DNA复制、重组、修复以及转录控制等生命活动的开展,染色质上的核小体定位一直处于动态变化之中,这种不断的变化需要一系列染色质重塑复合体的作用。
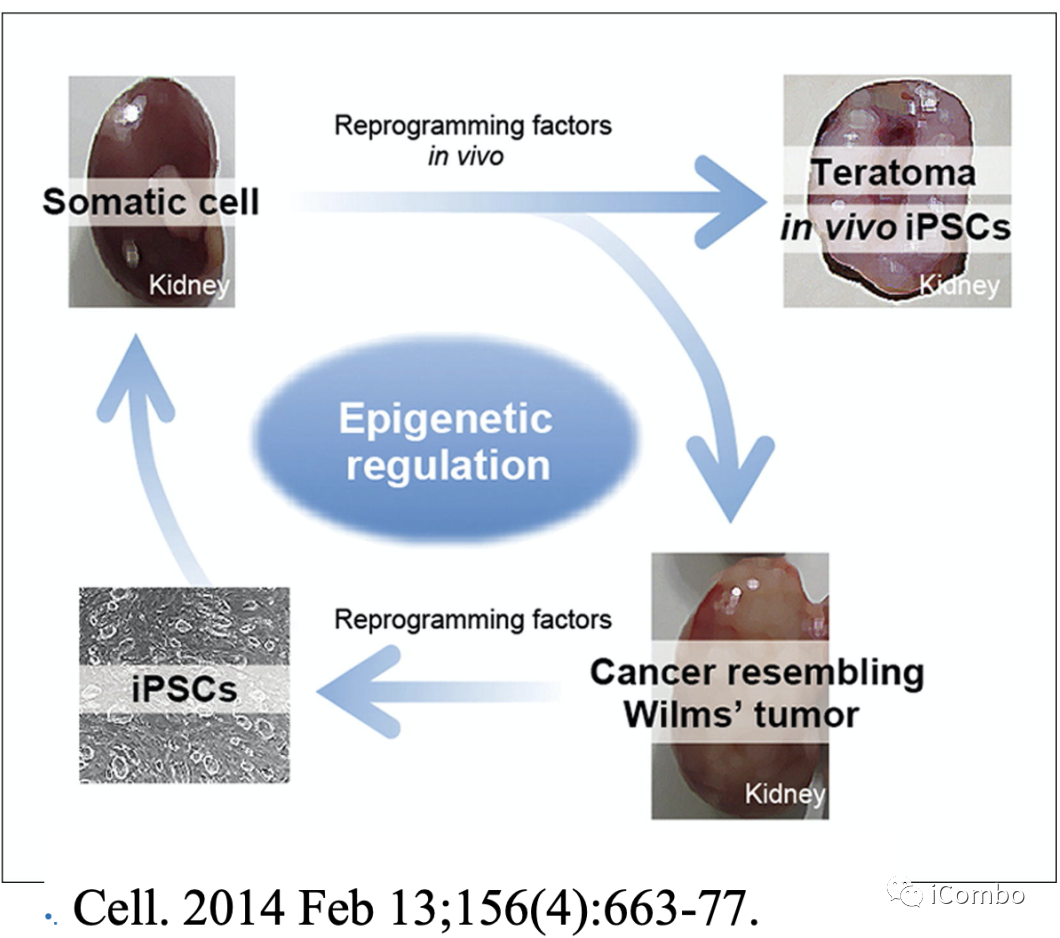
表观遗传变化是癌症风险的主要决定因素,在发育和老化的组织中不断被重塑。
作者引用一个文献,该文献通过建立一个小鼠模型说明:表观遗传重编程可以驱动肿瘤发生,但这种转化是可逆的,表明不可逆的遗传变化不是肿瘤形成所必需的。
至少有两种广泛的表观遗传学改变会影响细胞状态和癌症易感性
-
一种类型涉及到在发育和衰老过程中发生的染色质和组蛋白标记的正常重塑。在胚胎中,特定的表观基因组构型在时间和位置受限的祖细胞中准备形成多样化的后代细胞,这些细胞分布在每个器官的每个解剖环境中。但这些特定的表观遗传状态预示着细胞的顺从性,这也使它们对特定突变特别敏感。
-
虽然在激烈的有丝分裂过程和早期分化发育压力下进化出抑制癌症的机制,对细胞可塑性的要求也许可以解释为在儿童时期癌症很罕见,但并非完全没有。
-
与年龄相关的表观基因组重塑也可能导致老龄化期间癌症风险增加。在正常组织中,DNA甲基化的变化与实际年龄密切相关,有一些证据表明,“表观遗传学年龄比实际年龄大”的个体患癌症的风险增加。衰老HSC的表观遗传学变化增强了自我更新并阻碍分化,建立了易受转化影响的基因组景观。
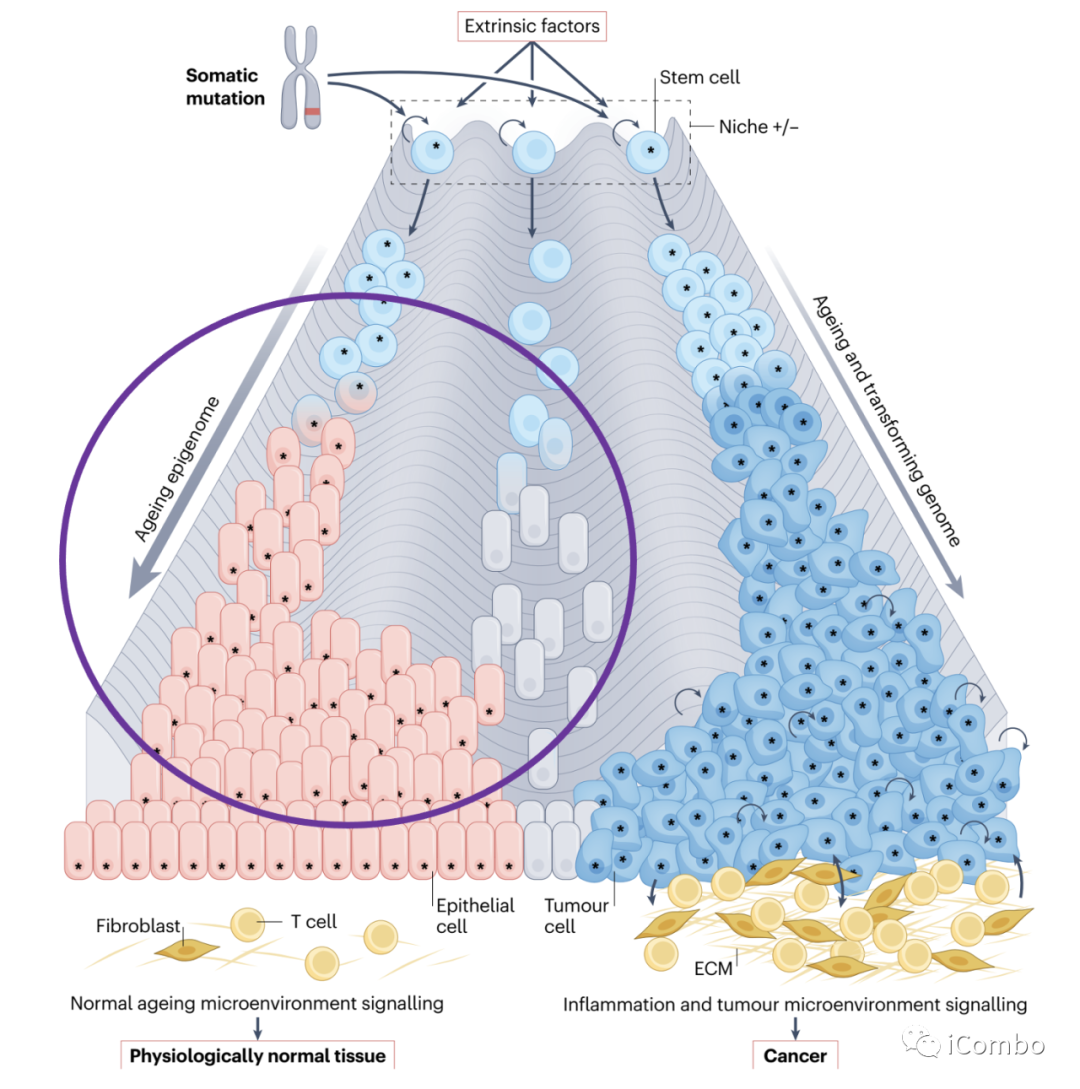
Fig. 5 | Origins of adult cancer.
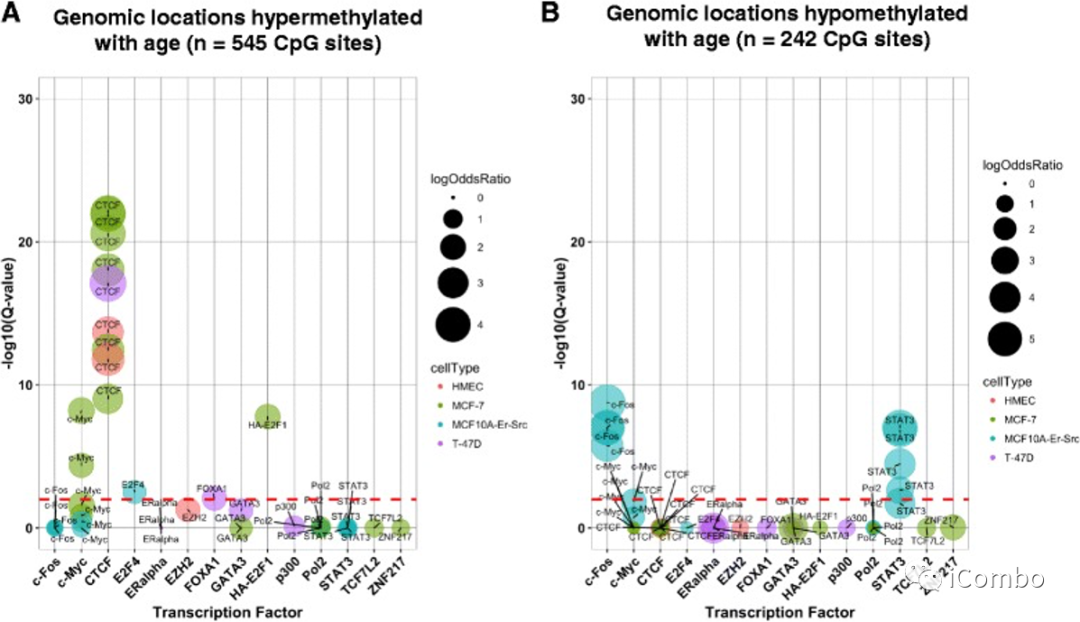
Breast Cancer Res 2017 Jul 10;19(1):81.
在787个随年龄差异甲基化的位点中,许多位点位于基因增强子和转录因子结合位点。乳腺癌在这些随年龄差异表现出甲基化的位点显示出进一步的 DNA 甲基化失调。
至少有两种广泛的表观遗传学改变会影响细胞状态和癌症易感性
-
第二种包括组蛋白和表观遗传调控因子的突变,以及肿瘤抑制基因的转录沉默。组蛋白经常发生的突变改变了神经胶质瘤、肉瘤和淋巴瘤内的表观基因组模式,从而破坏了基本的DNA模板相关过程,包括基因转录和DNA损伤修复。
-
在衰老个体的血液中,DNA甲基转移酶3A(DNMT3A)、四甲基胞嘧啶双加氧酶2(TET2)或ASXL1(编码多梳群蛋白)的突变会导致造血克隆的逐渐扩增(称为不确定潜能的克隆性造血(CHIP)),并增加患白血病的风险。HSC或祖细胞中DNMT3A的突变是一种早期癌前事件,其导致基因调节元件的CpG低甲基化,上调在介导干性中重要的基因。
-
表观遗传修饰因子的突变本身可能创造了一个适合转化的表观遗传状态。关于肿瘤抑制基因的表观遗传沉默,这可能包括模仿大片染色体缺失的抑制染色质广泛区域。
-
因此,为发育和衰老的组织提供生成和维持组织可塑性的表观遗传重塑,可能会使这些组织有诱导肿瘤发生的风险。
03 DNA突变
DNA突变概念:是指DNA分子中发生的序列改变,它可能在DNA复制过程中自发地产生,通常由DNA复制过程中的错误累积导致。
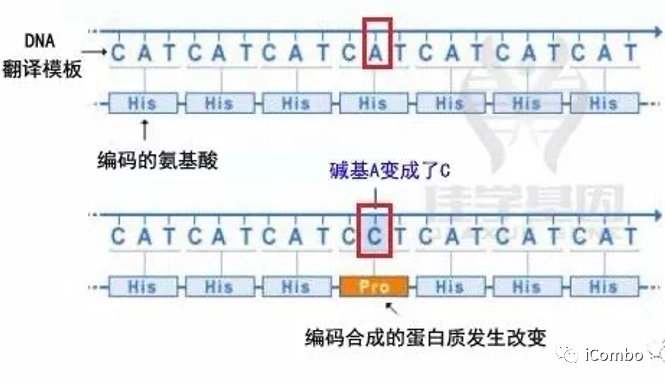
1、错义突变
是指一个DNA碱基对的改变导致编码的氨基酸由原来的一种变成了另一种。
2、同义突变
同错义突变类似,也是由于一个碱基对的改变导致编码的氨基酸由原来的一种变成了另一种,但不同的是这种改变导致产生终止密码子,细胞翻译肽链提前终止。其中密码子改变成UAG的无义突变又叫琥珀突变,密码子改变为UAA的无义突变又叫赭石突变
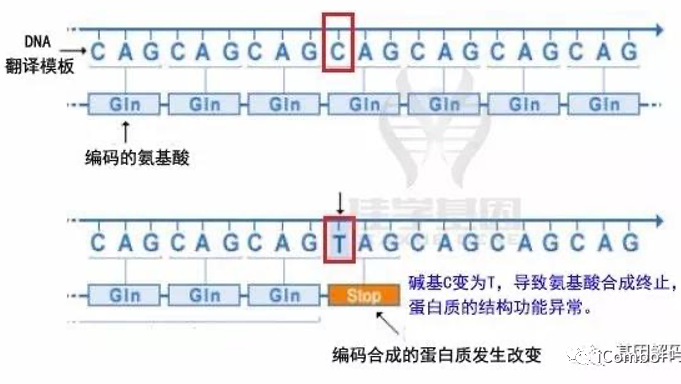
3、插入突变
插入一个或一段DNA序列,改变了基因的解读方式。结果,由该基因产生的蛋白质可能完全不能正常运行。
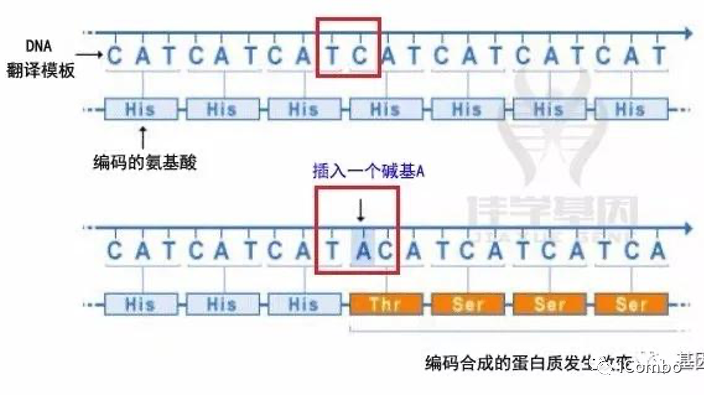
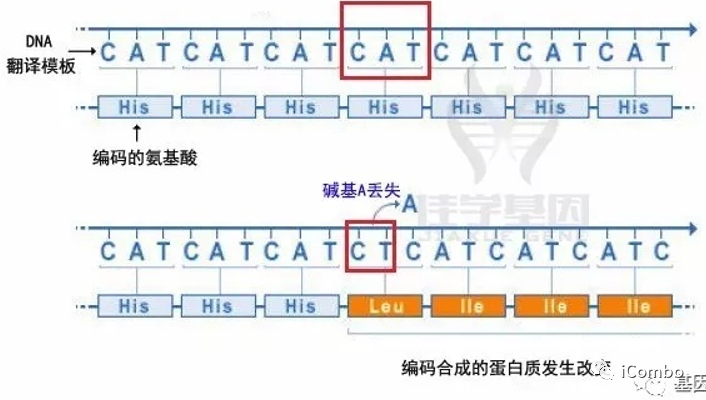
4、缺失突变
小缺失可以是基因内的一个或几个碱基对丢失,而大的缺失可以删除几个相邻基因甚至是整个基因,从而改变编码蛋白质的功能。
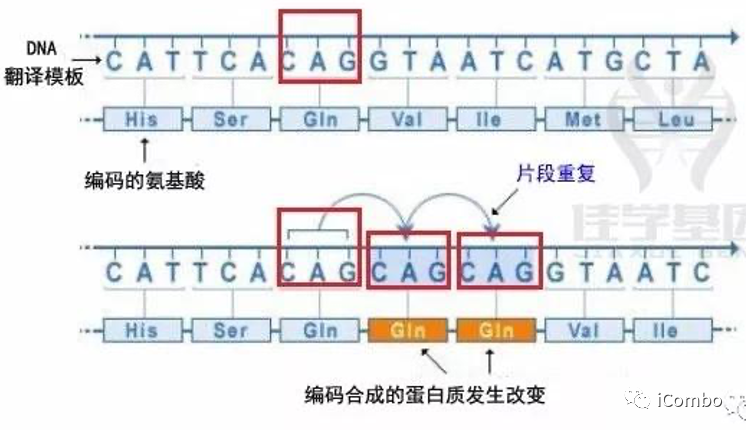
5、重复突变
增加了DNA序列重复的次数,导致所得蛋白质不正常地发挥功能。
6、移码突变
通俗的来讲就是编码(氨基酸)的密码发生了错位,从而改变了编码合成氨基酸的种类,最终导致蛋白质的结构功能发生改变。其中,插入、缺失和重复都可以是移码突变。
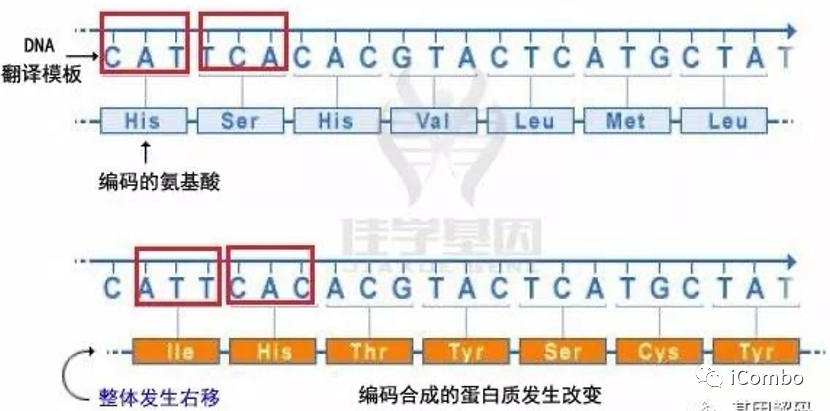
癌症长期以来一直被认为是一种基因组疾病。目前来源于数千对人类癌症测序的研究表明,肿瘤平均会获得四到五个“驱动”突变,并且这种突变会随着年龄的增长而增加。这些数据与几十年前流行病学研究的预测惊人地一致,这些研究首次激发了癌症体细胞突变理论,并支持了厄运理论;
现有的大量序列数据揭示了突变和癌症风险之间更为复杂的关系。同义突变——那些不会改变蛋白质序列的突变——被认为只是癌症的乘客,而非同义突变被认为是疾病的“驱动因素”。
酵母中的大规模CRISPR工程研究表明,同义突变和非同义突变同样影响细胞适应性,尽管这一点还有待更广泛的验证。此外,癌基因同义突变的选择可以影响癌症中的RNA剪接和转录。事实上,尽管宿主组织中癌症发病率存在显著差异,但人类干细胞来源的小肠、结肠和肝脏类器官获得突变的比率非常相似。此外,与成年人相比,青少年不易患癌,但胎儿神经干细胞、肝脏干细胞和肠道干细胞积累了大量突变其发病率高于其成年,并具有更大的增殖能力。因此,除了突变和干细胞增殖之外的其他因素可能决定细胞是否容易转化。
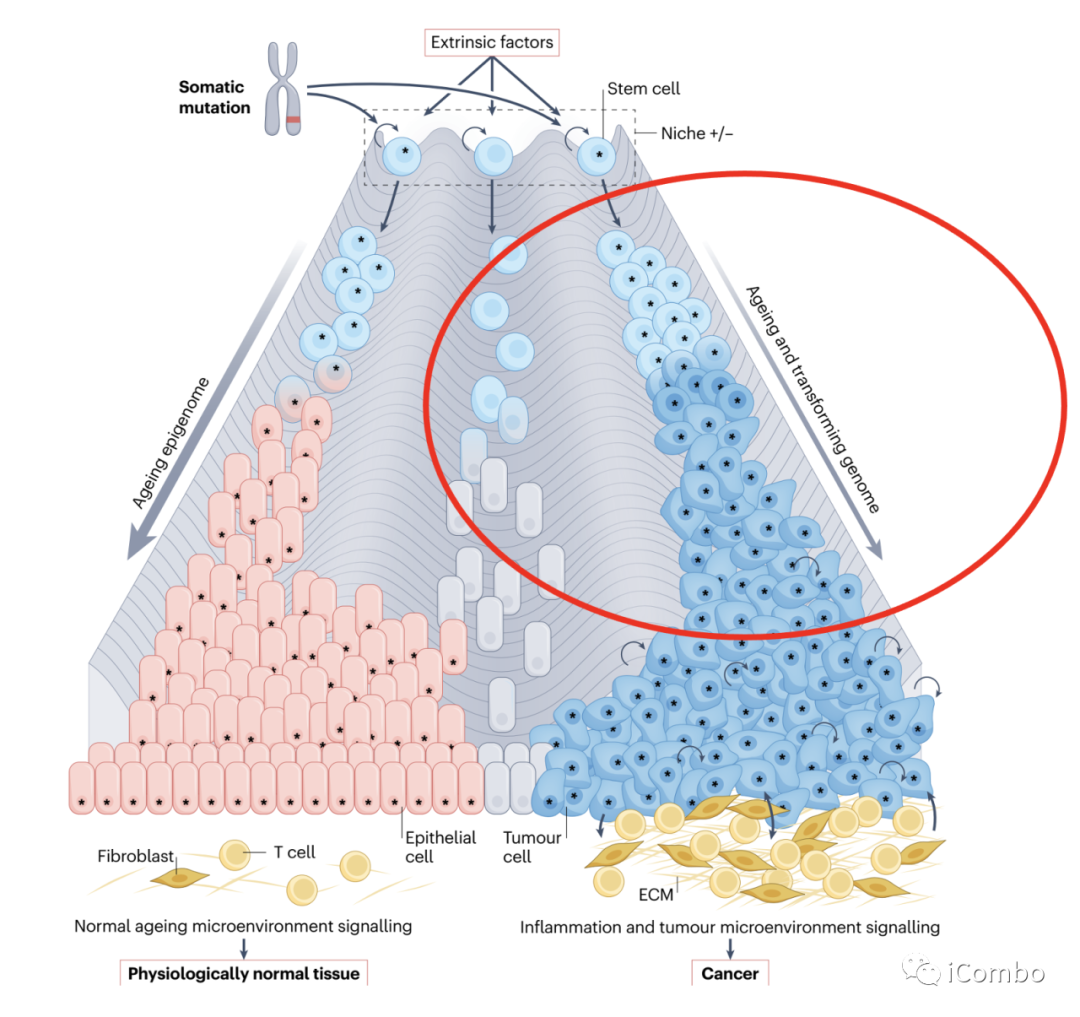
生理上正常的组织可以耐受大量的致癌突变,虽然眼睑皮肤很少形成癌症,但其组织内却隐藏着大量的驱动突变克隆体;衰老的肺、食道和结肠也是癌症的常见部位。尽管违反常规认知,但这种突变克隆的积累很可能是衰老上皮的有益甚至“正常”特征。

Nature. 2021 Oct;598(7881):510-514.
作者建立了一个假设模型
假设:肿瘤存活取决于它们相对于周围正常组织的竞争适应性,预测3种可能的情况:
1、肿瘤细胞比正常邻近上皮细胞中的克隆更适应(左),使平衡向肿瘤生长倾斜;
2、肿瘤细胞没有邻近正常上皮细胞(中)适应,导致肿瘤消退和消除;
3、肿瘤细胞和邻近正常上皮细胞同样适合(右),导致二者抗衡。
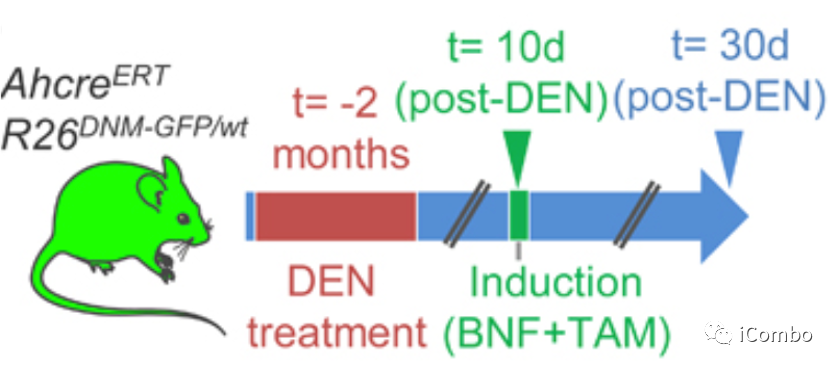
使用AhcreERT/R26DNM-GFP/wt(MAML-Cre)小鼠,其携带抑制Notch信号传导的 Maml-1(DN-Maml1)的诱导型高度竞争显性负突变等位基因。
上图是AhcreERT/R26DNM-GFP/wt 小鼠接受DEN两个月。在DEN戒断后10天诱导 DN-Maml1克隆,20天后收获组织。对照组小鼠接受 DEN,但未被诱导。
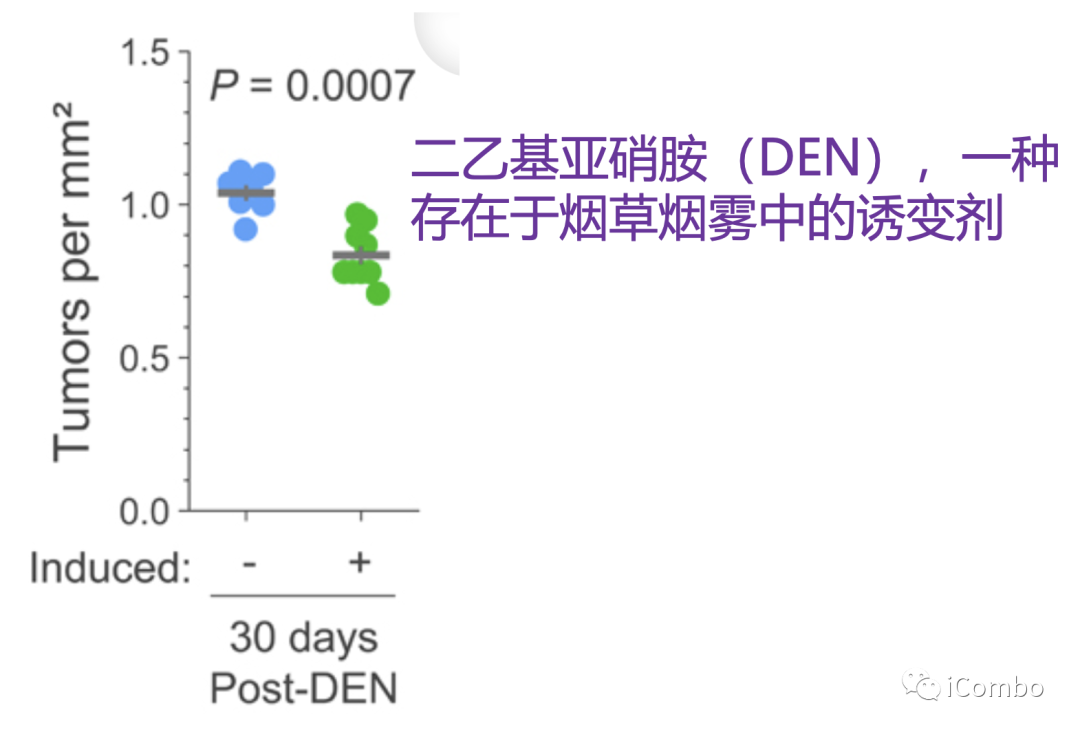
下图是AhcreERT/R26DNM-GFP/wt小鼠中每平方毫米食管上皮的肿瘤数目。
数据显示:扩增相邻正常食管上皮细胞的突变体克隆消除早期肿瘤。所以表明,并非突变就一定导致肿瘤,并且突变并不全是致肿瘤作用。
小结
癌症风险比以前所认识到的要复杂得多:在这个过程中,发育、衰老和受损的干细胞的不断变化决定了它们对转化突变的易感性,这一过程与癌症的组织结构域和基态理论相一致。这并不意味着支持“坏运气”理论的观察是错误的,因为干细胞的增殖能力可能与其身份的其他方面密切相关。但是,如果我们要制定有效的癌症预防策略,关键是要了解干细胞的确切特征,使其易于转化,而且还要调控表观遗传学和基因的突变。
作者:iCombo
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肿瘤知识库# 知识全面
20
#癌症# #流行病学# #基态理论#
28