Cancer:高危多发性骨髓瘤,硼替佐米与来那度胺维持治疗结局无差异
2023-04-21 聊聊血液 网络
在获得随机临床试验的前瞻性数据之前,应针对每例患者定制移植后治疗策略,并考虑在HRMM新型治疗策略的临床试验中治疗,且基于来那度胺的治疗应仍是治疗选择的支柱。
高危多发性骨髓瘤 (HRMM) 患者通常定义为 17p 缺失/17号单体、t(14;16)、t(4;14)、t(14;20) 或gain 1q,在自体干细胞移植 (ASCT) 后结局较差。已知ASCT 后来那度胺维持治疗可延长无进展生存期 (PFS) 和总生存期 (OS),这使得来那度胺维持治疗广泛采用并作为大多数骨髓瘤患者的标准治疗。但一项汇总分析认为HRMM患者未从来那度胺维持治疗中获得生存获益,而HOVON研究认为将硼替佐米纳入诱导和维持治疗可改善 HRMM 患者的生存结局,因此蛋白酶体抑制剂(如硼替佐米或卡非佐米)已成为高危骨髓瘤患者诱导治疗方案中的关键药物。然而在新药时代,在 HRMM 患者中对比来那度胺单药治疗与其他维持/巩固治疗方案(尤其是基于硼替佐米的治疗方案)的数据有限,也未确定 HRMM 患者的最佳维持策略,且不同实践中患者 ASCT 后维持的治疗建议可能存在相当大的差异。
近日《Cancer》发表的一篇研究中,作者使用国际血液和骨髓移植研究中心 (CIBMTR) 数据库,旨在研究在一线 ASCT 后接受来那度胺单药维持治疗的 HRMM 患者的结局是否劣于其他方案,尤其是接受基于硼替佐米的巩固/维持治疗的患者。


CIBMTR 是一个由全球500多个移植中心组成的自愿工作组,本研究人群包括2013年至2018年期间接受三联新型药物诱导后12个月内接受诊断一线 ASCT 的 HRMM 美国成人患者。
高危细胞遗传学特征定义为存在以下至少一种异常:17p缺失/17号单体、t(14;16)、t(4;14)、t(14;20) 或1q,异常1q包括gain 1q(3个 1q 拷贝)和amplification 1q(≥4个 1q 拷贝)。高危患者进一步分为两组:(1) 具有传统高危特征伴或不伴 1q 异常的HRMM(17p/单体17、t[14;16]、t[4;14]、t[14;20],伴或不伴 1q 异常),称为 a 组; (2) 1q 异常不伴其他高危标志物,称为 B 组。根据国际骨髓瘤工作组分类定义缓解。研究的主要结局是PFS,其他结局包括复发/进展和OS。
患者
503例患者符合研究标准,其中357例 (67%) 接受来那度胺单药维持治疗,146例 (33%) 接受硼替佐米为基础的维持治疗(硼替佐米单药85例,58%;硼替佐米+来那度胺58例,40%;硼替佐米+其他3例患者,2%)。基线特征见表1。
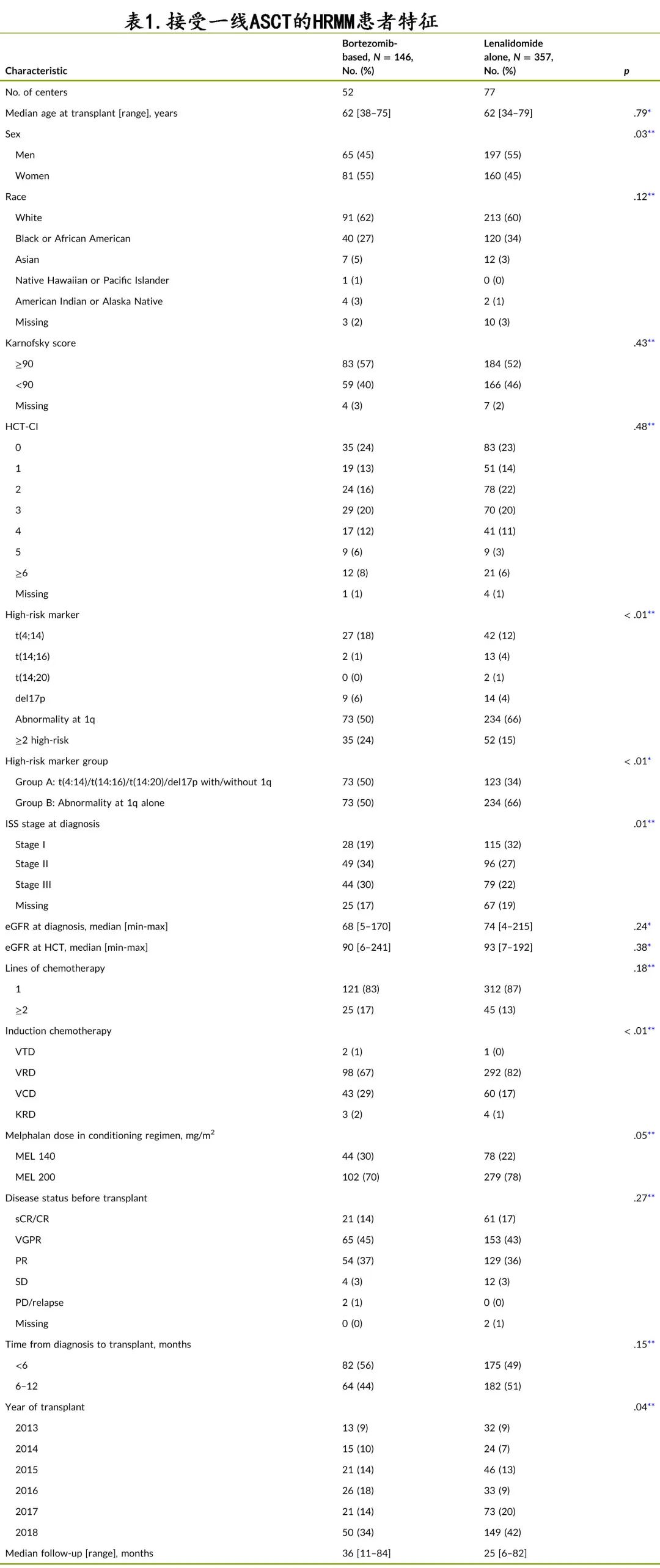
接受硼替佐米为基础维持治疗的患者与接受来那度胺单独维持治疗的患者具有相似的人口统计学,包括年龄、人种、性别和体能状态。但与来那度胺组相比,硼替佐米组患者A组异常更多(50% vs. 34%;p<0.01);与来那度胺组相比,硼替佐米组患者存在≥2种高危异常(24% vs. 15%;p<0.01)和国际分期系统 III 期(30% vs. 22%;p=0.01)的比例也更高。无论是诊断时还是移植前,两组的肾功能均无差异,但硼替佐米组的患者ASCT 前更多接受VCD诱导治疗(29% vs. 17%;p < 0.01),更少接受RVD 诱导治疗(67% vs. 82%;p<0.01),硼替佐米组患者接受美法仑 200 mg/m2 全剂量预处理也更少(70% vs. 78%;p=0.05)。
缓解率
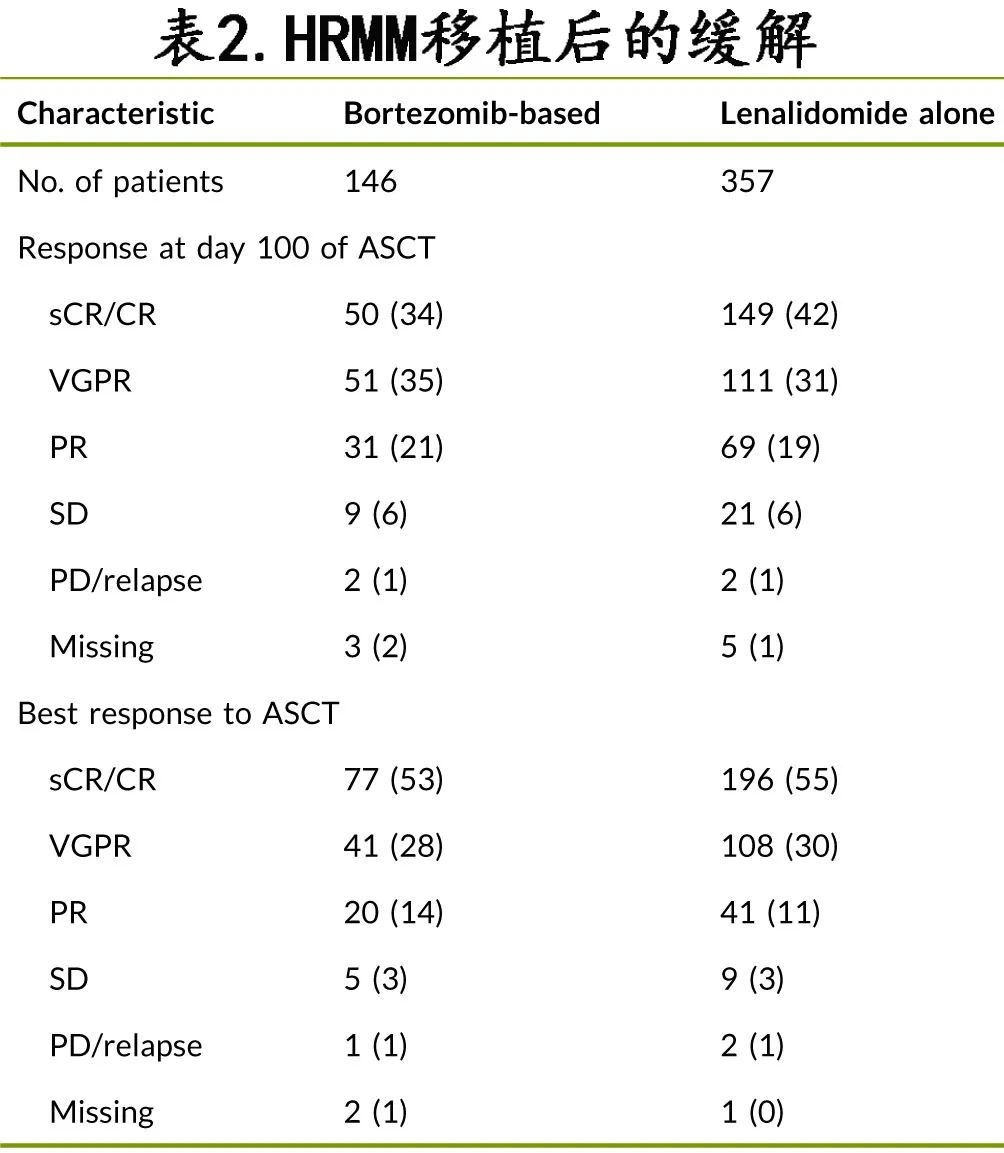
两组ASCT 前的缓解率无差异,包括硼替佐米组与来那度胺维持治疗组的≥VGPR率(59% vs.60%;p=0.27;表1)。两组 ASCT 后100天时的缓解率也相似,包括≥VGPR率 (69% vs. 73%) 和CR率 (34% vs. 42%)(p=0.66;表2);此外ASCT后的最佳缓解也相似,包括≥VGPR率(81% vs. 85%)和CR率 (53% vs. 55%)(p=0.69)。
结局
表3为硼替佐米组和来那度胺组患者之间的结局对比。
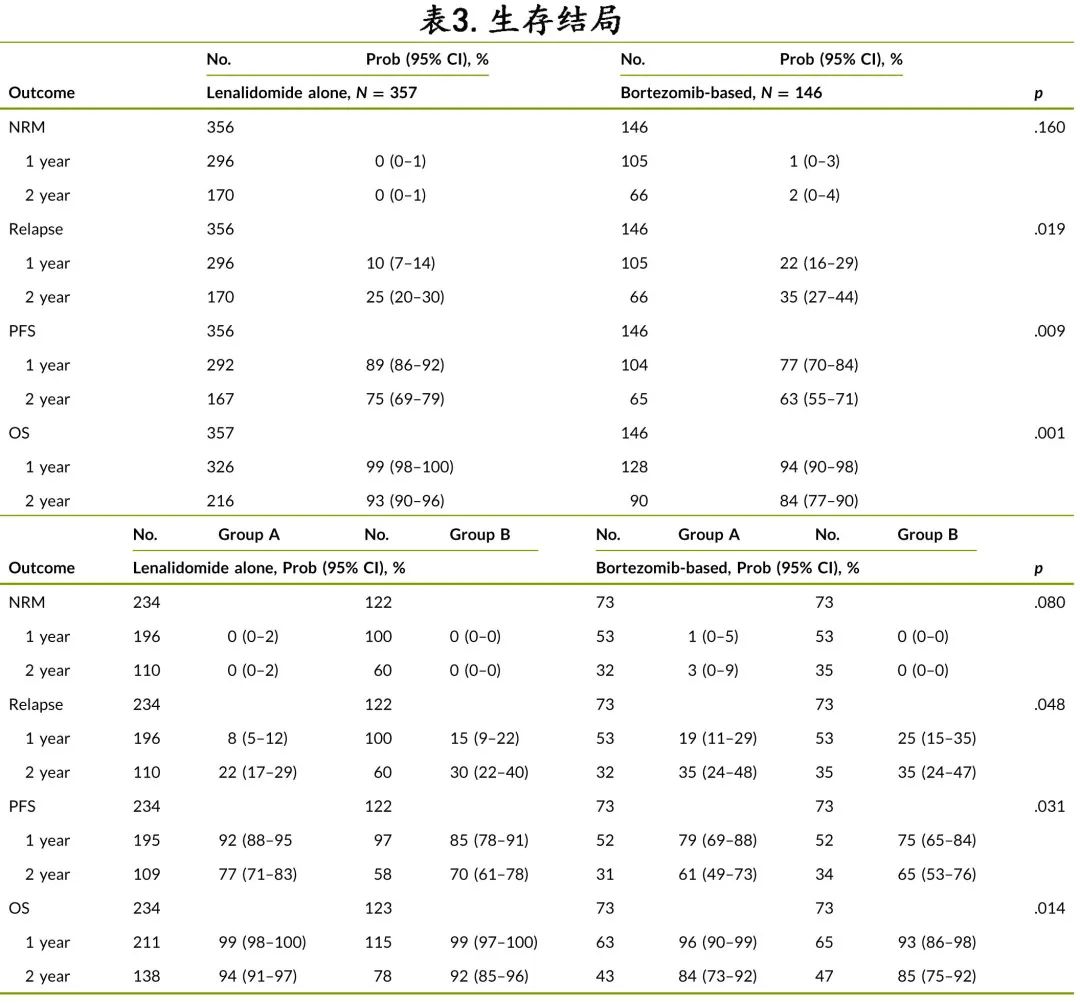
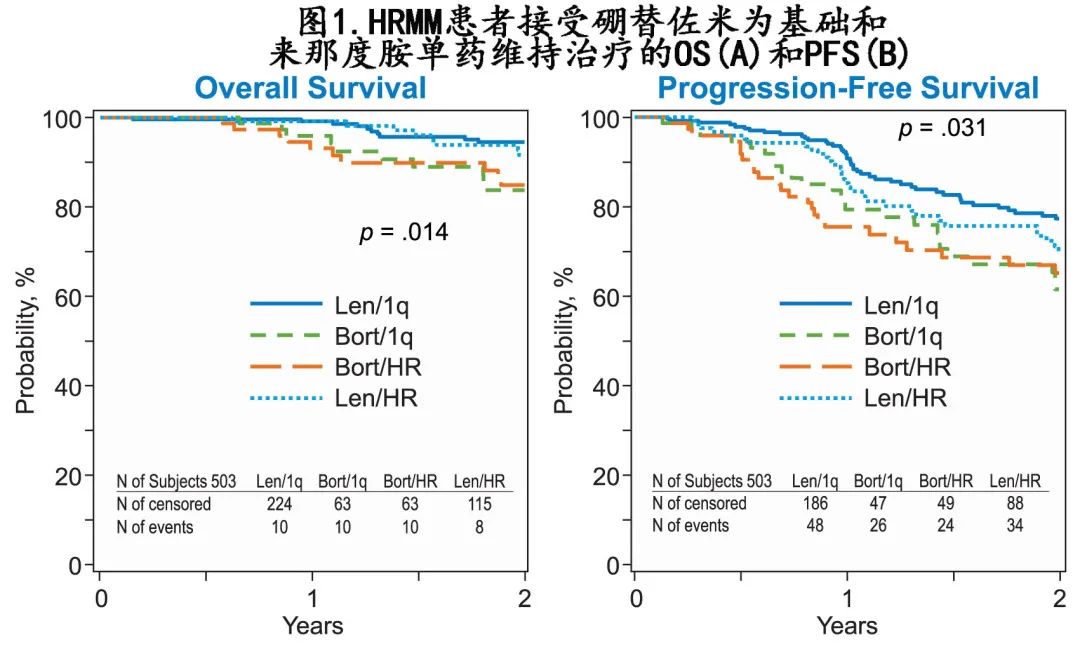
A 组接受来那度胺治疗的中位随访时间为30个月,A组接受基于硼替佐米的维持治疗为36个月,B组接受来那度胺治疗为25个月,B组接受基于硼替佐米的维持治疗为36个月。硼替佐米组和来那度胺组的2年非复发死亡率相似(分别为2% vs. 0%;p=0.16),而来那度胺组的2年 PFS 优于硼替佐米组(75% vs. 63%;p=0.009),2年 OS 也更优(93% vs. 84%;p=0.001)。A组中接受来那度胺与硼替佐米维持治疗的2年 PFS 和 OS 分别为77% vs 61%(p=0.009)和94% vs 84%(p=0.006),er B 组分别为70% vs 65% (p=0.385) 和92% vs 85% (p=0.109)。图1为4组的 PFS 和OS。
多变量分析
表4为多变量回归模型的结果。
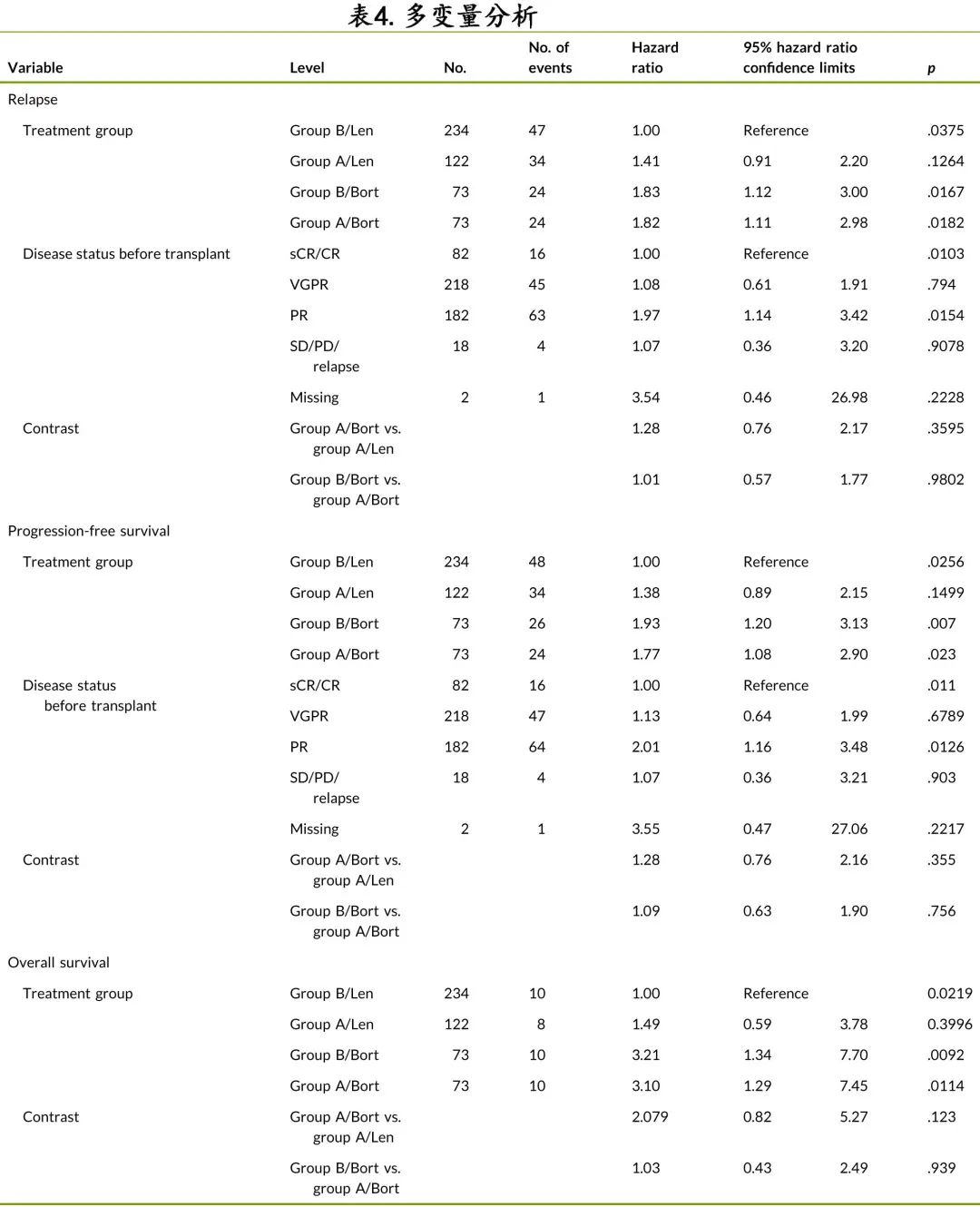
PFS:B组接受来那度胺维持治疗作为对照,A组接受来那度胺维持治疗未观察到差异(HR=1:38;95%CI,0.89-2.15;p=0.15),A组接受基于硼替佐米的维持治疗(HR=1.77;95%CI,1.08-2.90;p=0.02)和B组接受基于硼替佐米的维持治疗(HR=1.93;95%CI,1.20-3.13;p=0.007)的结局更差。此外在 A 组中,硼替佐米组与来那度胺组的 PFS 无统计学显著差异(HR=1.28;95%CI,0.76-2.16;p=0.36);但在 B 组(即单独1q异常)中,与来那度胺维持治疗相比,基于硼替佐米的维持治疗PFS 较差(HR=1.93;95%CI,1.20-3.13;p=0.007)。ASCT 前≥VGPR也与更优的 PFS 相关(总体p=0.01)。
OS:具有相似的相关性。以 B 组接受来那度胺维持治疗作为参照组,A组接受基于硼替佐米的维持治疗(HR=3.21;95%CI,1.34–7.70;p=0.009)和 B 组接受基于硼替佐米的维持治疗(HR=3.10;95%CI,1.29-7.45;p=0.011)的OS 较差。A 组中,硼替佐米组与来那度胺组的 OS 无差异(HR=2.08;95%CI,0.82-5.27;p=0.12)。在接受基于硼替佐米维持治疗的 A 组与 B 组中也未观察到 OS 差异。
亚组分析:美法仑200mg/m2
由于与来那度胺组相比,基于硼替佐米组的患者接受全剂量美法仑 200 mg/m2预处理剂量的比例较低,作者对接受美法仑 200 mg/m2 的患者进行了亚组分析。本组47例接受硼替佐米联合来那度胺维持治疗,54例接受硼替佐米单药或硼替佐米联合其他维持治疗,279例接受来那度胺单药维持治疗。结果与总体队列非常相似,来那度胺组的2年 PFS 优于硼替佐米组(来那度胺维持治疗组为76%,硼替佐米+来那度胺组为63%,硼替佐米组为56%;p=0.005),且来那度胺组的 OS 也更好(来那度胺组为94%,硼替佐米+来那度胺组为85%,硼替佐米组为78%;p<0.001);多变量分析的结果也与总体队列的结果相似。
本研究在传统高危异常患者中,未观察到基于硼替佐米与来那度胺维持治疗的结局差异,且硼替佐米组中的大多数患者接受了单药硼替佐米维持治疗,此外单独 1q 异常患者接受来那度胺维持治疗具有优效结局。在获得随机临床试验的前瞻性数据之前,应针对每例患者定制移植后治疗策略,并考虑在HRMM新型治疗策略的临床试验中治疗,且基于来那度胺的治疗应仍是治疗选择的支柱。
参考文献
Naresh Bumma,et al .Impact of bortezomib‐based versus lenalidomide maintenance therapy on outcomes of patients with high‐risk multiple myeloma.Cancer . 2023 Apr 6. doi: 10.1002/cncr.34778.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言