特应性皮炎瘙痒的神经免疫机制及治疗研究进展
2024-08-30 海龙话皮 海龙话皮
本文通过探讨AD瘙痒产生的神经免疫学机制及治疗的研究进展,旨在为AD瘙痒的治疗和管理提供新思路。
当前,国内外对瘙痒的研究仍处于起步阶段,虽然已经确定了一些相关受体和信号通路,但对瘙痒信号的产生、传导及调控机制仍不完全清楚。长期的慢性瘙痒严重影响AD患儿的生长发育、心理健康和生活质量,为家庭和社会带来沉重的负担。
因此,探索AD慢性瘙痒的产生机制及靶向治疗策略具有重要的理论及现实意义。本文通过探讨AD瘙痒产生的神经免疫学机制及治疗的研究进展,旨在为AD瘙痒的治疗和管理提供新思路。
AD瘙痒的基本特征
瘙痒是一种引发强烈搔抓欲望的特异性皮肤感觉,根据起源不同大致可分为4类:皮肤源性瘙痒、神经源性瘙痒、神经病理性瘙痒和心理性瘙痒,其中皮肤源性和神经源性瘙痒是AD瘙痒的主要类型。
AD瘙痒程度轻重不一,可表现为阵发性、间断性或持续性。通常,这种瘙痒广泛分布于全身,但也可局限于身体某一部位。目前尚不确定瘙痒是否在AD之前发生,但在AD患者中存在瘙痒-搔抓的恶性循环,搔抓会加剧瘙痒。

AD瘙痒具有特征性,通常伴有红斑,并常见痒觉敏感(alloknesis)和痒觉异常(atmoknesis),也可表现为夜间瘙痒伴睡眠障碍,且瘙痒程度通常与病情严重程度呈正相关。由于搔抓可以促进神经肽、细胞因子和其他炎症介质的释放,加重瘙痒和红斑,形成持续的瘙痒-搔抓循环,相较于其他瘙痒性皮肤病,AD患者更容易进入这种恶性循环。出汗、干皮症、皮肤微血管变化、情绪激动、外源性刺激(如搔抓、毛料制品、使用脂溶剂或防腐剂等)、变应原、微生物及刺激性食物等均可参与AD瘙痒的形成。
AD瘙痒形成的基本过程及传递通路
AD瘙痒的感知和神经传导涉及皮肤、脊髓背根神经节(dorsal root ganglion,DRG)、脊髓和大脑。皮肤感觉神经纤维起源于DRG的胞体,可以分为Aδ和C类纤维等,它们终止于血管、毛囊、汗腺、表皮和真皮,其中与瘙痒相关的感觉神经纤维主要是无髓鞘的C类纤维。当AD患者皮肤稳态失调时,外部刺激或皮肤炎症会产生内源性致痒因子,与相应受体结合后从而触发瘙痒信号,通过Aδ和C类纤维传至DRG,位于DRG的初级感觉神经元胞体释放胃泌素释放肽(gastrin-releasing peptide,GRP)和B型利钠肽(B-type natriuretic peptide,BNP)等神经递质传至脊髓背角的二级神经元,随后通过脊髓丘脑通路或脊髓-臂旁核通路将信号投射到导水管周围灰质、纹状体和前扣带皮质等大脑区域,从而引起瘙痒感觉。
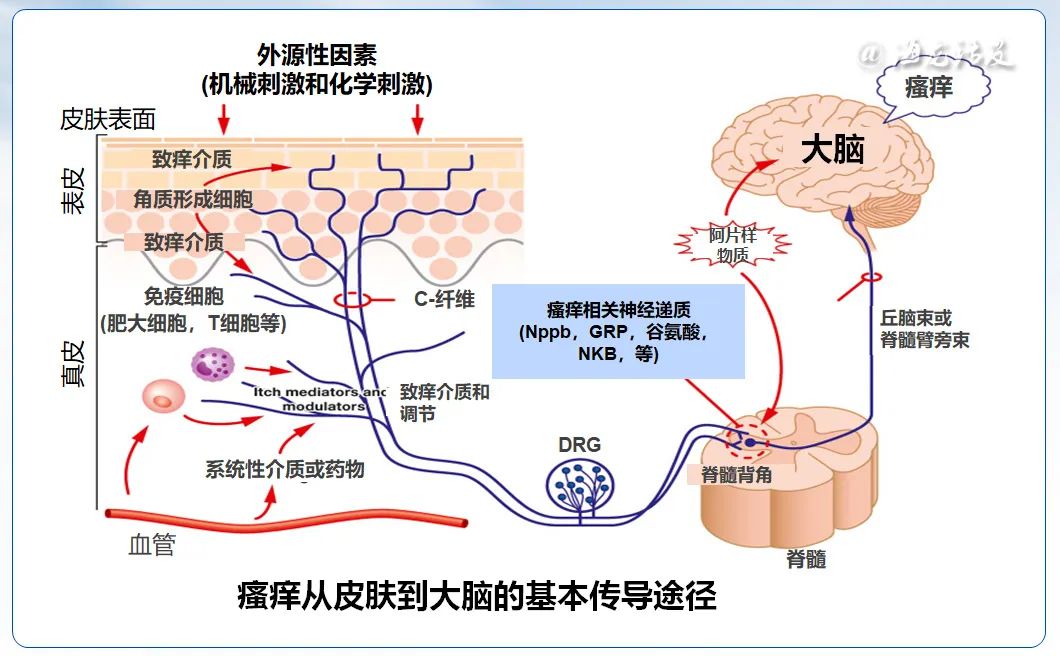
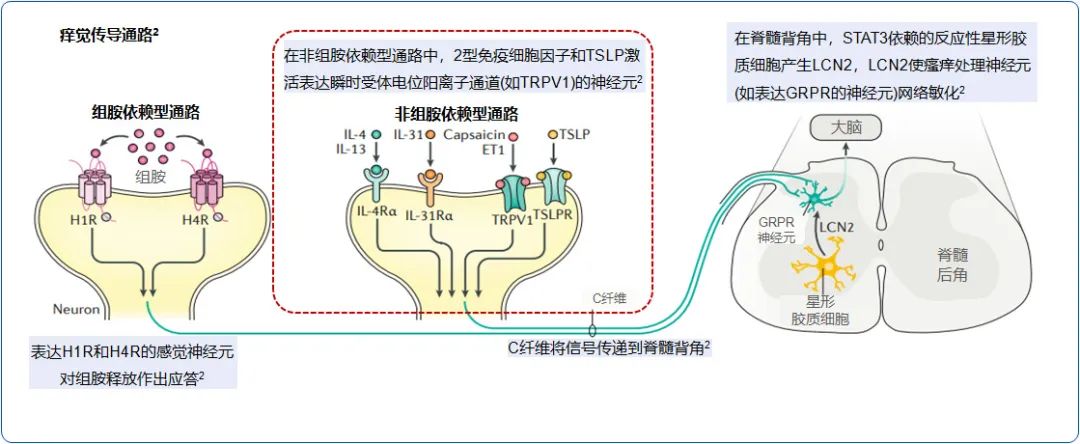
瘙痒信号传递通常涉及两条途径,分别是组胺依赖途径和非组胺依赖途径。这两种途径分别激活不同的皮肤神经纤维亚群,并在瘙痒信号传递的各个层级中表现出显著的分离特性。在组胺依赖途径中,组胺、P物质(substanceP,SP)、前列腺素、5-羟色胺通过组胺H1受体(H1R)-磷脂酶C(phospholipaseC,PLC)、磷脂酶A2(phospho-lipaseA2,PLA2)-瞬时受体电位香草酸受体1(transient receptor potential vanilloid1,TRPV1)启动痒信号,而组胺非依赖通路中,刺毛黧豆诱发的瘙痒通过蛋白酶激活受体2(proteinase activated receptor2,PAR2)-PLC-TRPV1/TRPA1传递痒觉信号,氯喹(chloroquine,CQ)等通过Mas相关的G蛋白偶联受体A3(Mas related G-protein coupled receptor memberA3,MrgprA3)-TRPA1传导痒觉信号。由于抗组胺药在治疗AD瘙痒方面作用有限,目前普遍认为AD的慢性瘙痒主要由非组胺依赖途径介导。
AD瘙痒相关受体和介质
AD瘙痒相关受体及通路
Mrgprs是G蛋白偶联受体(Gprotein-coupled receptors,GPCRs)家族中的一类独特受体,其成员大多特异性分布在DRG和三叉神经节的非肽能神经元中,这提示它们可能在感觉传递中具有特殊作用。近年来,在小鼠实验中对Mrgprs瘙痒相关研究取得了一定进展。例如,有研究证实小鼠MrgprA3介导了CQ引起的瘙痒反应。Zhu等在小鼠干性皮肤模型和接触性皮炎模型中发现MrgprA3和MrgprC11过度表达,而缺乏这两种受体的小鼠搔抓行为显著降低。与此一致的是,人类的Mrgprs在AD患者中被证实上调,这进一步证实Mrgprs介导AD瘙痒的发生。
PARs属于GPCRs家族,PAR2和PAR4是PARs家族的2个成员,它们在炎症、疼痛等生理和病理过 程中扮演着关键角色,并且可以诱导非组胺依赖性瘙痒。研究表明,在AD患者的皮损性和非皮 损性皮肤中,PAR2在角质形成细胞(keratinocyte,KC)上的表达均上调,其中皮损性皮肤的表达水平更高。最近一项研究指出,金黄色葡萄球菌是通过V8蛋白酶切割PAR1受体来激活感觉神经元,导致瘙痒和抓挠行为。这些发现揭示了PARs家族在传递瘙痒感觉中的重要作用。
瞬时受体电位(transient receptor potential,TRP)通道家族是一类参与感觉传导的离子通道,其中TRPV1、TRPV3、TRPV4、TRPM8、TRPA1等通道在瘙痒信号的产生和传递中发挥着关键作用。TRPA1在非组胺依赖性瘙痒过程中扮演关键角色,作为一种冷敏感的钙通道,在温度低于17℃时被激活,增加细胞内钙离子浓度,促进感觉神经元兴奋。TRPV1通道是一种热敏感离子通道,广泛表达在皮肤和感觉神经元中,参与疼痛、体温调节和瘙痒等过程。除了对高温敏感外,TRPV1还可以被多种化学物质如辣椒素、蛋白酶和酸性溶液等激活,引发疼痛和瘙痒感觉。
AD瘙痒相关炎症介质及神经递质
细胞因子在免疫和炎症过程中发挥关键调节作 用,并在瘙痒的发生和传导中扮演重要角色。已知与AD瘙痒相关的细胞因子包括白细胞介素-4(IL-4)、IL-13、IL-31、IL-33和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)等。IL-31是一种由T细胞产生的细胞因子,通过结合其受体IL-31R进行信号传导,该受体在KC和DRG痒觉神经元上均有表达。其诱导迟发性瘙痒,此过程需要TRPV1和TRPA1的参与,体现了瘙痒介质之间错综复杂的相互作用。
此外,研究还发现IL-31水平与AD的病程严重程度以及瘙痒程度呈正相关。在成纤维细胞、内皮细胞和KC中,IL-33表达对2型免疫反应起着关键作用。最近研究发现,IL-33可以增强DRG神经元对CQ瘙痒刺激的反应能力,尽管CQ不是内在的瘙痒介质,但这表明IL-33可以增加CQ敏感神经元产生痒觉的敏感性。
TSLP是一种主要的诱导辅助性T细胞2(T helper cells2,Th2)分化的细胞因子,研究发现,AD患者KC和朗格汉斯细胞中TSLP的表达上调。TSLP已被鉴定为一种新的内源性瘙痒介质,可能通过激活免疫细胞分泌刺激感觉神经元的炎症介质IL-4、IL-13、IL-31以间接引起瘙痒。此外,活化后的Th2、肥大细胞等分泌IL-4、IL-13和IL-31,这些因子和TSLP可以直接刺激周围神经元引起瘙痒。这些细胞因子共同构成了一个复杂的瘙痒调控网络,在AD瘙痒中发挥重要作用。
神经肽是由神经元分泌的一类具有生物活性的肽类物质,其中包括SP、降钙素基因相关肽(calcitonin gene-related peptide,CGRP)、GRP和BNP等,这些神经肽在瘙痒过程中发挥着关键作用。研究表明,AD患者血清及病变皮损中SP水平升高,SP能与神经激肽1受体(neurokinin1 receptor,NK1R)结合,释放瘙痒介质导致瘙痒。SP还能激活肥大细胞释放其他炎症介质,如白三烯B4(leukotrieneB4,LTB4)、前列腺素D2(prostaglandinD2,PGD2)和肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α), 从而引起瘙痒。此外,SP还与Mrgprs结合在伤害性瘙痒中发挥重要作用。
阿片类物质在AD瘙痒中展现出复杂的调控作用,主要通过μ阿片受体(μ0pioid receptor,MOR)和κ阿片受体(κ opioid receptor,KOR)的相互作用来实现的。MOR1D亚型与瘙痒感知相关的胃泌素释放肽受体(gastrin-releasing peptide receptors,GRPR)形成异二聚体激活PLC/三磷酸肌醇(inositol triphosphate,IP3)/Ca+通路诱导瘙痒发生。相反,KOR的激活会抑制瘙痒,有研究观察到AD患者的表皮中KOR下调,虽然具体机制尚未完全阐明,但AD瘙痒可能与MOR和KOR的表达失衡有关。
AD瘙痒与皮肤屏障-神经-免疫相互作用
AD伴随着皮肤屏障功能异常,其中一个关键表现是患者皮肤中神经酰胺含量减低,这种关键脂质的缺失导致经皮失水(transepidermal water loss,TEWL)增加。丝聚蛋白(filaggrin)是一种结构蛋白,对维持角质层的完整性进而预防水分流失起着关键作用,在亚洲人群中,FLG基因突变是AD的一个重要风险因素。
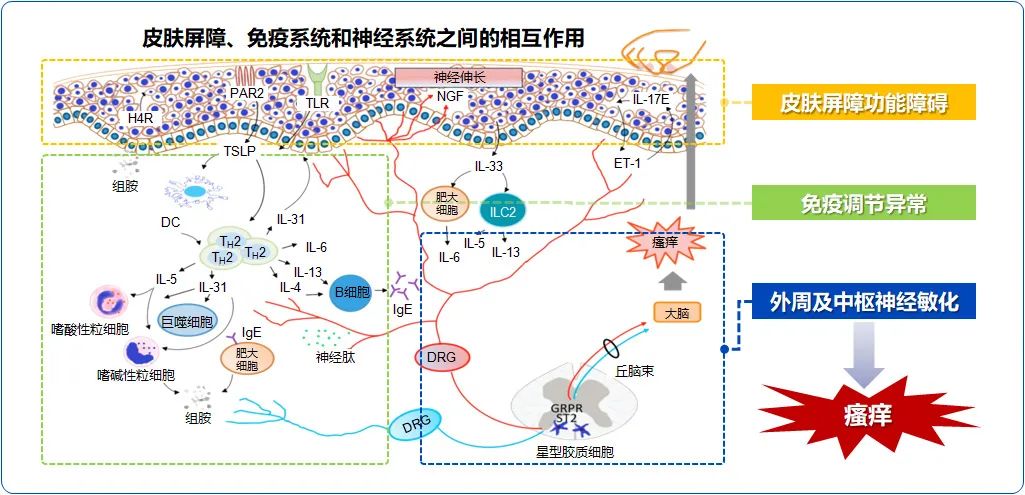
皮肤干燥是AD的显著特征,可能是TEWL增加和FLG基因突变等多重因素共同作用的结果。当皮肤屏障结构发生改变导致皮肤干燥时,表皮中的感觉神经纤维伸长且分布密度增加。这一过程受神经伸长因子(nerve elongation factors,NEFs)和神经抑制因子 (nerve repulsion factors,NRFs)的调节,其中神经生长因子(nerve growth factor,NGF)、双调蛋白(amphiregulin,AR)等均属于NEFs,而脑信号蛋白3A(Semaphorin3A,Sema3A)属于NRFs。与健康人群相比,AD患者皮肤中NGF水平升高,可能使原发性传入神经更加敏感,从而导致慢性瘙痒。有研究表明将Sema3A局部应用到AD小鼠皮肤上,可以降低表皮中神经纤维密度,恢复皮肤屏障,并抑制抓挠行为,这表明Sema3A可能是一个调节表皮神经纤维的潜在治疗靶点。
在AD发病的过程中,无论急性期或慢性期,都涉及Th2型炎症反应。KC在受到机械刺激(如抓挠或暴露于过敏原等)时会释放TSLP、IL-25、IL-31等细胞因子,其中TSLP能够引起AD免疫级联反应。TSLP主要来源于上皮细胞,通过与由IL-7受体α(IL-7Rα和TSLP受体(TSLPR)组成的异二聚体复合物结合实现其生物学功能。TSLP可诱导DC上调CD80、CD86和OX40L等共刺激分子,促进幼稚CD4+T细胞前体向Th2细胞增殖分化,引起Th2型免疫应答。2型炎症因子的释放会影响脂质成分、FLG基因表达等,进一步破坏皮肤屏障功能。此外,TSLP通过激活分布于外周传入C纤维的TSLPR,与PLC耦联引起TRPA1离子通道开放,进而传递瘙痒感觉,表明TSLP能直接激活痒觉神经传递瘙痒信号,提示TSLP可作为AD瘙痒的治疗靶点。

总之,AD瘙痒涉及到皮肤屏障功能、神经系统及免疫系统之间的复杂互动。KC释放的细胞因子激活感觉神经引发瘙痒感,激活的感觉神经又释放神经递质,刺激KC和免疫细胞,加剧局部免疫反应,形成正反馈环。2型免疫细胞及其产物不仅直接导致瘙痒,还通过影响KC和神经敏感性,加剧炎症与瘙痒的恶性循环。因此,皮肤-神经-免疫轴多维度失衡是AD瘙痒复杂性的主要原因。
AD瘙痒的治疗
基础疗法
有研究指出,AD患者皮肤pH值高于正常人群,这可能与其瘙痒感增强有关,因此,建议AD患者使用低pH值的清洁产品和保湿产品。表皮屏障功能受损是导致AD瘙痒的重要机制之一,使用润肤剂可以建立有效屏障,减少水分流失,从而减轻瘙痒感。神经酰胺是角质层细胞间脂质的重要组成部分,这种富含脂质的基质可以防止表皮水分流失,并阻止化学物质、感染性病原体和过敏原进入表皮。然而,AD患者皮肤中神经酰胺水平下降,富含神经酰胺的护肤品已被证实可以保护和滋润表皮,有助于促进表皮的重建。因此,采用富含神经酰胺的护肤品可能有助于改善AD患者的皮肤状况。此外,通过健康教育提高患者的自我管理意识,减少引发或加重症状的因素也是至关重要的。
传统止痒疗法
外用糖皮质激素(topical corticosteroids,TCS)是AD的一线疗法,尽管其直接缓解瘙痒的证据有限,但临床实践表明TCS的局部使用可以改善患者的瘙痒症状。外用钙调神经磷酸酶抑制剂(topical calcineurin inhibitors,TCI)可以抑制T细胞的活化和免疫介导的炎症反应,从而减轻AD患者皮肤的炎症,缓解瘙痒感。
辣椒素,一种天然生物碱,对瘙痒显示出治疗潜力,可能通过作用于TRPV1受体实现神经纤维脱敏而发挥效用。鉴于金黄色葡萄球菌感染常加剧AD瘙痒,因此,控制细菌感染也是治疗AD瘙痒的重要一环。最近有研究表明,金黄色葡萄球菌通过V8蛋白酶-PAR1轴来驱动瘙痒,这一发现为缓解由金黄色葡萄球菌引起的AD瘙痒提供了新的治疗靶点。
光疗是一种安全有效的治疗AD瘙痒的方法,尽管其作用机制尚不完全清楚,使用光疗可使皮肤感觉神经纤维减少,可能是其止痒作用的原因。光疗通过减少T细胞来减少炎症,间接针对瘙痒。推荐首选安全有效的窄谱中波紫外线(NB-UVB)和中大剂量UVA1治疗,配合外用糖皮质激素及保湿剂。对于慢性顽固性瘙痒控制不佳者,也可尝试米氮平、普瑞巴林、帕罗西汀、纳曲酮等系统止痒药物治疗,但需注意其不良反应。
对于重度AD患者,可考虑系统应用免疫抑制剂,如环孢素A(CyclosporineA,CsA)、甲氨蝶呤等。CsA是一种针对T细胞的强效免疫抑制剂,它通过与细胞内的受体结合,抑制IL-2等细胞因子的转录,从而影响T细胞的活化。试验表明,CsA的持续治疗可显著减轻瘙痒的严重程度。对病情严重、其他药物难以控制的急性发作期患者可短期应用糖皮质激素,待病情好转后及时减量停用。
生物制剂及小分子药物
随着对AD发病机制研究的不断深入,涌现出多个治疗靶点和候选药物,为患者带来更多的治疗选择。度普利尤单抗(Dupilumab)通过与IL-4和IL-13共同受体IL-4Rα结合,有效抑制信号转导,从而下调了酪氨酸激酶-信号转导与转录激活子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)通路下游受体信号,显著改善AD患者皮肤炎症与瘙痒状况。曲洛吉努单抗(Tralokinumab)是一种抗IL-13的单克隆抗体,在Ⅲ期试验中显示能有效提升中重度AD青少年患者的治疗反应率及瘙痒缓解程度。抗IL-31RA的单克隆抗体奈莫利珠单抗(Nemolizumab)通过与IL-31竞争性结合IL-31RA,阻断IL-31信号传导路径,达到抑制瘙痒的目的。迪高替尼(Delgocitinib)对JAK1、JAK2、JAK3和Tyk2具有抑制作用,通过抑制免疫细胞和炎症细胞的活化从而减轻皮肤炎症及瘙痒症状。迪高替尼软膏是全球首个局部外用的JAK抑制剂,已在日本上市,适用于2岁以上儿童和成人AD患者。巴瑞替尼(Baricitinib)是一种选择性JAK1/JAK2抑制剂,作用于多种细胞因子,包括IL-4、IL-5、IL-13、IL-22和IL-31,这些细胞因子参与了AD的发病机制。巴瑞替尼片2017年经欧洲药品管理局批准用于接受系统治疗中度至重度AD成年患者,规格有2mg和4mg,目前尚未在中国获批。乌帕替尼(Upadacitinib)和阿布昔替尼(Abrocitinib)是口服小分子JAK1抑制剂,在Ⅲ期临床试验中,表现出在青少年人群中的治疗潜力。克立硼罗(Crisaborole)是一种磷酸二酯酶4(phosphodies-terase,PDE4)抑制剂,其临床研究证实能有效减轻各年龄段轻中度AD患者的瘙痒症状。这些创新药物的出现,标志着AD治疗正迈向更加精准与高效的阶段。
小结与展望
中国特应性皮炎诊疗指南强调AD的治疗目标,包括缓解症状、减少复发、提高生活质量,而治疗瘙痒是其中至关重要的一环。瘙痒发病机制异常复杂,涉及到皮肤屏障功能障碍,免疫系统和神经系统的错综关系。随着对发病机制研究的深入,生物制剂的引入已为众多患者开启新的治疗希望。尽管如此,该领域仍有许多未知的挑战亟待解决,要求我们持续探索与研究,旨在不断进步,更精准高效地服务于临床实践,为患者带来更多福祉。
参考文献:
1.杨晓宇,姜姗姗,孙丹等.特应性皮炎瘙痒的神经免疫机制及治疗研究进展[J].山西医科大学学报,2024,8(55):1082-1088.
2.中华医学会皮肤性病学分会免疫学组,特应性皮炎协作研究中心.中国特应性皮炎诊疗指南(2020版[J].中华皮肤科杂志,2020,53(2):81-88.
3.郝飞.特应性皮炎瘙痒的机制及对策[J].中国医学文摘(皮肤科学),2016,33(2):144-147.
4.其他文献(略)。
作者:海龙话皮
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#瘙痒# #特应性皮炎# #神经免疫机制#
40